SLE患者の悩ましい倦怠感はどうマネジメントするか?
SLEではしばしば倦怠感が患者さんを苦しめる事があります。疾患の活動性ばかりに目が言っているとついつい患者さんの訴えを軽んじてしまうかもしれません。
治療のガイドラインの進歩も著しいですが、”倦怠感”という少し取っ付きにくい領域についても医療者は知っておきたい所です。
今回はつい最近発表された『SLE患者さんの倦怠感のマネジメント』というReviewをご紹介致します。
原因はもちろん、心理療法を含めたマネジメントについても具体的に言及されていますので、ご参考になれば幸いです。
- Backgrounds
- Step 1:SLEに関係のない倦怠感の原因を探す
- Step 2:有効なPROを用いた疲労の客観的評価
- Step 3:SLEに関連した倦怠感の原因を特定する
- Step 4:複雑な心理的決定要因を探す
- SLE患者の倦怠感管理の実践に向けて
- Conclusion
Backgrounds
●SLEは慢性の自己免疫疾患であり、倦怠感などの自覚症状だけでなく、幅広い臨床症状を引き起こす可能性がある。
●SLEでは、倦怠感は患者の67%から90%の患者に報告されている(PMID=30597077/19153144/24592329)。
●また、最近の多施設共同研究(FATILUP)で示されたように、有効な倦怠感の測定指標を使用して、最大で3分の1の患者で重度と評価されている(PMID=30597077)。
●また、倦怠感は患者から疾患の最も衰弱する症状として報告されることが多 く、健康に関連したQOLの変化を引き起こしたり、仕事が出来ない事によって間接的に莫大な費用を必要としたりする。
●倦怠感の合理的な評価と治療は、特に活動性のない患者において、SLEにおける大きな課題となっている。
●注目すべきは、倦怠感は非常に多因子的な概念であり、SLEの場合は、原疾患に関連したものとそうでないもののどちらかが原因となっている可能性があることである。
●重要なことは、これらの原因は心理行動学的な決定要因と複雑に絡み合っていることである。
●ここでは、SLEにおける疲労の一般的な評価と管理のための実用的なステップバイステップのアルゴリズムを提案する(下図)。
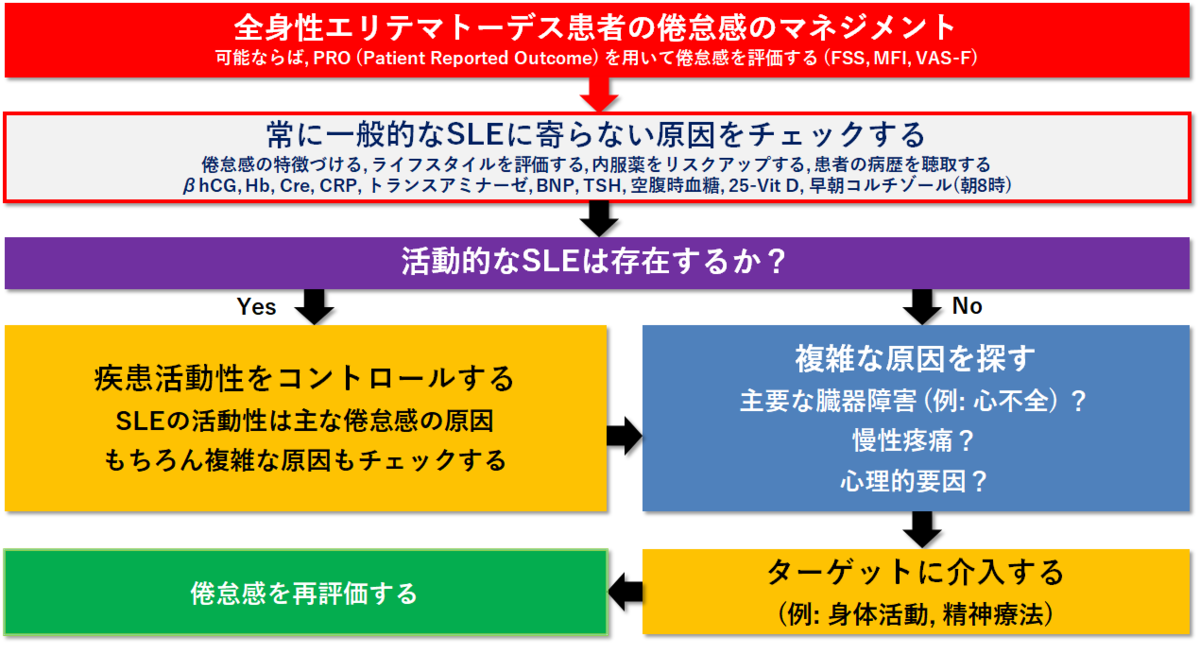
Step 1:SLEに関係のない倦怠感の原因を探す
●プライマリーケアでは、急性倦怠感を呈した患者の3分の2以上に内科的または精神科的な診断が見られる。
●倦怠感の最も頻度の高い原因を下表にまとめる。

※赤文字は小生が追加
●患者の視点、倦怠感の詳細な病歴、患者の気分や仕事、家事、身体活動、余暇などの日常活動への影響を理解することが非常に重要である。
●下ボックス1には、倦怠感のある患者と対峙した際の主な質問をまとめてい る。

●薬物によっては倦怠感を誘発する可能性があるため、現在服用している薬物の見直しが推奨される (例:β遮断薬などの降圧薬や鎮静剤)。
●生活習慣の評価も重要である: SLEでは喫煙と倦怠感の間に有意な関連性が報告されている。
●また、肥満は一般の人でもSLEでも倦怠感の増加と関連している(PMID=29740985)。
●心臓、肺、甲状腺、神経系の網羅的な検査が重要である。
●女性の場合は、特に貧血の場合には、婦人科の検査も推奨される。
●検査では、炎症マーカーや感染症、貧血、腎不全や肝不全、ウイルス性肝炎やHIV感染、異常な高Ca血症、甲状腺機能低下症、糖尿病、副腎機能不全(特に最近グルココルチコイドを中止した患者の場合)などの主要な内分泌・代謝合併症など、倦怠感の最も一般的な原因 (Box 1) を除外すべきである。
●現在のガイドラインに従ってがん検診を行い、悪性腫瘍の間接的徴候(食欲不振、体重減少、リンパ節腫脹)を注意深く探すべきである。
●議論の余地はあるが、ビタミンDの欠乏はSLEの倦怠感と関連している(PMID=22004972)。
●SLE患者80人を対象とした観察研究では、ビタミンDの補給は参加者の倦怠感を改善した(PMID=20235208)。
●また、若年性SLEを対象とした無作為化比較試験では、ビタミンD補給は倦怠感スコアの減少と関連している(PMID=25988278)。
Step 2:有効なPROを用いた疲労の客観的評価
●倦怠感は非常に主観的な症状であるため、検証されたPatient Reported Outcome (PRO: 患者が報告する指標)を用いた倦怠感の標準化された評価が重要なステップである。
●検証済みのPROを使用することで、倦怠感の強度や症状を経時的に個別にフォローアップすることができ、患者レベルで治療的介入の有益性を強調するのに役立つ場合もある。
●また、医師が倦怠感の原因を理解し、治療することに純粋に関心を持っていることを示す方法でもあり、これは患者の視点から見て重要であり、医師と患者の信頼関係を確立するのに役立つ。
●SLEで使用されている16の異なる倦怠感PROのうち、FSS (Fatigue Severity Scale) とshort-FSSが最も使用されているが、MFI (Multi-dimensional Fatigue Inventory) とFatigue-VASも使用されている (下表) 。

●FACIT-Fatigueスコアは臨床試験では一般的に使用されているが、日常臨床ではあまり使用されていない。
Step 3:SLEに関連した倦怠感の原因を特定する
●倦怠感は活動性のあるSLEの症状だが、臓器障害との関連もある(下図)。
●疾患活動性と倦怠感の関係については、SLEではまだ議論の余地があり、不安や抑うつなどの他の要因と比較して、あまり強くないことが示されている。
●血清学的マーカー(C3、抗dsDNA抗体)との関連性も議論の的となっている (PMID=19714612)。

●倦怠感はいくつかのSLE特有の臓器症状と関連している:
-いくつかの研究では、白質病変(PMID=17872980)を含む神経学的病変と倦怠感の間
に関連があることが明らかにされている(PMID=19714612/10787006)。
-腎不全は倦怠感の重要な原因となりうる。腎不全が活動性腎疾患と関連しているの
か、慢性病変(損傷: Damage)と関連しているのかを評価することが重要である
(PMID=31167183/24694985)。
-心不全は明らかな倦怠感の原因である。
-肝不全および肝硬変は、(まれに)ループス肝炎が原因であることがあり、自己免
疫性肝炎やより頻度の低い硬化性胆管炎と重なることがある
(PMID=28317620/12772788)。
●SLEの他の臨床症状は倦怠感と関連している:FATILUP研究では、SLEDAIの項目でもある関節炎と口腔潰瘍が重度の倦怠感と関連していることを発見した(PMID=30597077)。
●このことは、SLEにおける疼痛症状がより特異的な役割を果たしていることを示唆していると考えられる(PMID=19714612/23660302)。
●最後に、線維筋痛症の有病率はSLE患者の6.2%から22%と推定されている(PMID=26575317/19004039)が、倦怠感と強く関係する(PMID=27377815)。
●シェーグレン症候群もまた、Sicca症候群(目や口の乾燥)の患者では考慮すべきであり、いくつかの研究で有意な倦怠感との関連が認められている(PMID=11709451/27390247)。
Step 4:複雑な心理的決定要因を探す
●感情や機能的な健康状態、病気に関連した異常行動は、SLEにおけるうつ病や倦怠感と強く相関している(PMID=30597077/26848402/22704691)。
●痛み、ストレス、抑うつはSLE患者の倦怠感の最も重要な予測因子であることが示されている(PMID=30580659)。これらの症状の強さと結果は、必要に応じて心理学者や精神科医の助けを借りて評価されるべき。
●気分障害はSLE患者の最大13%で報告されており、約40%がSLEに起因している(PMID=25778456)。
●睡眠障害はSLEだけでなく、一般の人にも多く見られ、倦怠感やうつ病との関連も指摘されている(PMID=15818653/17143980/7779127)。
SLE患者の倦怠感管理の実践に向けて
●疾患活動性の高い患者では、主な治療目標は寛解(または低疾患活動性)であり、これらの目標を達成することで倦怠感を改善するのに十分な効果が得られる(PMID=27884822/12730519)。
●しかし、疾患活動性や背景の器質的疾患がなくても、著しい倦怠感が存在することは一般的である。
●このような患者では、免疫抑制剤治療の増量は必要なく、心理学的・行動学的評価や身体活動ワークショップなどの非薬理学的介入が好ましいとされている(PMID=33175957)。
●重要なことは、最適な身体活動の欠如や座りっぱなしの行動がSLEにおける倦怠感と関連していることである(PMID=12730519/12579589/29505598)。
●炎症性関節炎患者の疼痛と倦怠感の管理には、前回のEULARの勧告でも、身体運動が推奨されている(PMID=29724726)。
●身体活動はSLE患者の倦怠感を改善することが示されている(PMID=12730519/21497208)。
●中等度または高い身体活動に費やす時間が多いほど、倦怠感が少ないことが示されている(PMID=26869353)。
●原因不明の倦怠感を持つSLE患者は、専用の心理学的評価を受けるべきであり、行動的な問題は、必要に応じて適切な心理カウンセリン グと薬理学的介入を用いて特別にケアすべきである(PMID=25328393/30961418/29768969/30670099/17118041)。
●SLEにおける抗うつ薬の倦怠感に対する正確な効果は、具体的な試験がないため評価が困難だが、QT延長につながる可能性のあるヒドロキシクロロキンとの相互作用を考慮すれば、抗うつ薬による治療が適切と考える事はできない。
●喫煙は多くの薬剤の治療効果を著しく低下させ、フレアを促進する可能性があるため、禁煙を奨励すべきである(PMID=31520802)。
●最後に、ヒドロキシクロロキンの遵守状況を評価し、必要に応じて、予定外のヒドロキシクロロキン血清濃度を測定して、治療のアドヒアランスを確認し、毎日の服薬量を調整する必要がある(PMID=21575744/17324970)。
Conclusion
●重要な倦怠感はSLE患者の3分の2に見られ、重症の倦怠感は3分の1に見られる(PMID=30597077)。
●一般集団と同様に、SLEに関連していない倦怠感の原因を除外しなければならない。
●次に倦怠感が疾患活動性と関連するか、臓器障害と関連するか評価する必要がある。
●前者の場合、疼痛症状に重点を置いた寛解治療が最も適切な治療目標となる。
●重要なことに、いくつかの研究では、不安とうつ病の両方が倦怠感の主要な独立した予測因子となっている。
●これらの症状を十分に評価し、必要に応じて適切な心理カウンセリングと薬理学的介入を用いて注意を払うべきである。
【参考文献】
Philippe Mertz, et al. Lupus Sci Med. 2020 Nov; 7 (1): e000441. ”Towards a practical management of fatigue in systemic lupus erythematosus” PMID=33214160
間質性肺疾患を起こしやすいリウマチ膠原病とは?
関節リウマチや皮膚筋炎、強皮症などの全身性自己免疫性リウマチ性疾患(SARD)は、しばしば間質性肺疾患(ILD)を起こします。それぞれの疾患でどれくらいILDを起こしやすいかは、各国から様々なコホート研究が発表されていますが、どの疾患がどのくらいILDを起こしやすいか、同時かつ直接比較した研究はありませんでした。
本日は台湾の健康保険の大規模データベースを用いたコホート研究をご紹介します。
ご存じかもしれませんが、台湾の国民健康保険データベースは国民の99%以上が登録されている国民健康保険プログラム(NHI)に基づくデータベースです(PMID=26192815)。
従って『コホート研究には打って付け!』と言っても過言ではありません。
また同じアジア人でもあるため、日本人にとっては大変参考になるかと思います。
Patients & Methods
●1997年から2013年までの台湾国民健康保険研究データベースを用いて、2001年から2013年までに新たにSARDと診断された患者62,930人を同定。
●主なSARDは以下の通り。
-全身性エリテマトーデス
-関節リウマチ
-原発性シェーグレン症候群
-皮膚筋炎、多発性筋炎
-強皮症
●除外基準は以下の通り。
-上記SARDの診断がつく前に間質性肺疾患の診断を受けた患者
-上記SARDの重複患者
●年齢、性別、インデックス日(年)によってSARD患者と1:4でマッチングするように非SARD診断251,720人を選択。
●非SARD患者は上記のSARDと診断されていない患者とされた。
●インデックス日に間質性肺疾患と診断を受けていた患者は除外された。
●間質性肺疾患の定義は以下の通り。
①以下のICD-9-CMコードを含めた。
-515(炎症後肺線維症)
-516.3(特発性間質性肺炎)
-516.8(その他の肺胞・肺胞隔壁疾患)
-516.9(不特定の肺胞・肺胞隔壁疾患)
-517(Lung involvement in conditions classified elsewhere)
②最初の診断日の前後6か月以内に適切な放射線学的または病理学的診断を受けた。
●主要アウトカムはSARD診断からILD診断までの期間。
●カテゴリー変数は被験者の割合、連続データは平均±標準偏差(SD)で示した。
●カテゴリ変数間の差を評価するためにピアソンのχ2検定、連続変数についてはスチューデントのt検定を用いた。
●SARD-ILDの発症率は、10,000人年(総人年)あたりのSARD-ILDと新たに診断された被験者の数とした。
●SARDサブグループと非SARDサブグループ間でILDの発生率を比較。
●多変量Cox回帰分析を用いて、年齢、性別、Charlson併存疾患指数(併存疾患の数を測る代表的な指数)を調整した後、非SARD群と比較した各SARD群におけるILDのハザード比(HR)と95%信頼区間(CI)を推定。
Results
Baseline characteristics

●合計で、SARD患者62,930人と非SARD患者251,720人を同定。
●被験者同定のフローチャートは上図。

●上表に対象者の人口統計学的および臨床的特徴を示す。
●平均±SDの追跡期間は、SARD群で6.1年±3.5年、非SARD群で6.3年±3.5年。
●平均年齢と性別の分布は、SARD群と非SARD群で有意差なし。
●最も多かったSARDは関節リウマチで、次いで原発性シェーグレン症候群、全身性エリテマトーデス、全身性強皮症、皮膚筋炎、最後に多発性筋炎であった。Charlson併存疾患指数の平均±SDは、SARD群の方が非SARD群よりも高かった。
全身性自己免疫性リウマチ患者における間質性肺疾患の発症率

●上記にSARD群と非SARD群のILDの発症率の一覧を示す。
●非SARD群と比較して圧倒的にSARD群ではILDを発症するリスクが高い。
●SARD群ではILDを発症しやすい疾患は以下の順番である。
①全身性強皮症
②皮膚筋炎
③多発性筋炎
④全身性エリテマトーデス
⑤原発性シェーグレン症候群
⑥関節リウマチ
間質性肺疾患のリスクに関連する因子

●上記はILDと共変量との関連について、一変量および多変量のCox比例回帰分析の結果をまとめたものである。
●潜在的な交絡因子を調整した後、SARD患者ではILD発症リスクが有意に上昇した。
●多変量Cox回帰分析では、分析対象となった6種類のSARDsのいずれかを有する患者では、対応する対照群と比較してILDのリスクが増加していることが明らかになった。
●年齢は、すべてのSARD患者およびすべてのSARDサブグループにおいて、ILDの有意な危険因子であることが明らかになった。
●男性はすべてのSARD患者においてILDの有意な危険因子として同定されたが、サブグループ解析の結果、性別が男性であることははRAのみの患者においてILDの有意な危険因子であることが明らかになった。
●さらに、Charlson併存疾患指数はすべてのSARD患者において、pSSやRA患者と同様にILDの有意な危険因子であることが明らかになった。
まとめ
●台湾の大規模データベースの結果から全身性自己免疫性リウマチ性疾患では
①全身性強皮症
②皮膚筋炎
③多発性筋炎
④全身性エリテマトーデス
⑤原発性シェーグレン症候群
⑥関節リウマチ
の順番に間質性肺疾患の合併率が高い。
My comments
●臨床的感覚に非常に一致した結果だと思います。非SARD群と比較すると発生率比(IRR)は大変高く見えますが、実際の頻度はTable 2のEvent(%)を見ると、疾患毎のILDの発生率が分かるので、こちらもご覧ください。
●強皮症はタイプにもよりますが、日本から、限局皮膚硬化型で40%、びまん皮膚硬化型で71.1%に間質性肺疾患を合併するという報告(PMID=21874591)があり、『強皮症を見たら間質性肺疾患をスクリーニングする』と言われるぐらい間質性肺疾患の評価が重要です。
●混合性結合組織病(MCTD)も間質性肺疾患を起こす事があるため、解析に含めて欲しかったです。
●間質性肺疾患が先行する場合や、間質性肺疾患だけが注目されて、背景の自己免疫疾患がちゃんと診断されていない場合が今回は除外されてしまっているが、臨床的にこれらの条件の患者さんは多くないと考えられるため、今回のデータに強い影響は与えないと思われます。
【参考文献】
Kooi-Heng Ng, et al. Semin Arthritis Rheum. 2020 Oct; 50 (5): 840-845. "Risk of interstitial lung disease in patients with newly diagnosed systemic autoimmune rheumatic disease: A nationwide, population-based cohort study" PMID=32896697
SLEの診断と治療~Updated in 2020~
また、SLEに関して素晴らしいReviewが出ました。
このReviewが優れているのは、図表、アルゴリズムが多く用いられている点と、引用文献の多くが過去5年以内のものである点です。
それぞれの項目も少ない分量でまとめられており、読みやすいです。
是非、ご堪能下さい!!
- SLEの背景
- SLEの疫学と原因
- SLEの表現型と診断
- 活動性指標と臓器障害指標
- アウトカムの指標
- SLEのマネジメント
- 生存・死亡率、収入への影響
- 最近の臨床試験
- 未解決の疑問、新たなアンメットニーズ、将来の治療法
SLEの背景
●全身性エリテマトーデス(SLE)は、重症度と経過が異なる慢性の全身性自己免疫疾患であり、再発する事を特徴としている(下図: SLEの自然経過)。
●SLEでは、自然免疫と獲得免疫の両方が関与している。
●遺伝因子と環境因子の相互作用により、多くの免疫学的変化が生じ、自己の核酸に対する持続的な免疫反応が起こる。
●自己抗体や免疫複合体の沈着によって引き起こされる臓器障害は、腎臓、心臓、血管、中枢神経系、皮膚、肺、筋肉、関節などで発生し、重大な罹患率と死亡率の増加につながる。
SLEの自然経過

●SLEは発症前の無症状の時期から自己抗体が陽性となり、その抗体価は発症前にかけて急激に上昇する。
●従来の治療(上段)では再発(青線)を繰り返していくうちに臓器障害や感染症、動脈硬化、悪性腫瘍などの併存疾患(赤線)がどんどん増加する。
●Treat to Target戦略(寛解などの治療目標を立てて、ある期間内にそれを達成するように治療する戦略)により、再発や臓器障害を抑えることができる(下段)。
※図中のTreat-to-treatは誤植と考えられます。
SLEの歴史
●ヒポクラテス(紀元前460-375年)が最初にこの病気について、herpes ethiomenos(ἕρπης ἐσθιόμενος)または『かじる(gnawing)皮膚病』と呼んだ可能性がある。
●Herbernus of Toursは、西暦916年にループスという言葉を皮膚病に適用した。
●1872年には、Kaposiが狼瘡を円板状のものと、全身性のものに細分化し、致命的な結果をもたらす可能性のある全身性疾患の概念を導入した。
●SLEの歴史における重要なマイルストーンとしては、エリテマトーデス細胞(LE細胞)の記述、家族性に集簇することの認識、典型的な疾患パターンの欠如と診断のための全体像を考慮する必要性の認識、New Zealand Black/New Zealand White F1 lupusモデルマウスの発見などがある。
●1954年にヒドラジン誘発性狼瘡が報告され、1982年にはACRによるSLEの分類基準が発表された。
●1964年から1990年にかけて、重症SLEに対して高用量のグルココルチコイドと免疫抑制剤・細胞障害薬による治療が導入された。
●2011年には、SLEに対する最初の生物学的治療薬(ベリムマブ: ベンリスタ)が承認された(※日本における承認は2017年)。
SLEの疫学と原因
疫学
●SLEは女性が圧倒的に多く、男女比は1:10。
●全世界の調整有病率は成人10万人あたり50~100人に近づいているか、あるいはそれを超えている。
●発症率は10万人あたり年間0.3-31.5人で、過去40年間で増加している。
●白人の研究では、患者のほとんどは中年女性であり、発症時には症例の約50%が軽症である(図A)。

●しかしながら、患者の一部は重症化することがあり、軽症、中等症、重症は時間の経過とともに各カテゴリーの3分の1に等しく分かれている(図B)。

※これは少し前にご紹介した報告からの引用のようです。仕事が早いですね!!
●疾患の重症度は民族的背景によって異なり、一般的にアフリカ系やラテンアメリカ人の患者では重症化する。
●年間の直接的な(医療関連の)費用は、病気の重症度と関与する臓器に大きく関係しており、中等度から重症の患者では、米国では少なくとも3000~12,000米ドル、ヨーロッパでは2,500~5,000ユーロと推定されている。
環境因子、遺伝因子、他の自己免疫疾患との関連
●紫外線、喫煙、薬剤はSLEの発症に関連する環境因子として確立されている。
●少なくとも118種類の薬剤、特にプロカインアミドとヒドララジンは、ループスの発症と関連しており、抗TNF薬(インフリキシマブ、アダリムマブ、エタネルセプト)は抗DNA抗体の産生と関連している。
●すべてのループス関連自己抗体の中で、抗リン脂質(aPL)抗体および抗DNA抗体は喫煙と関連している(PMID=24692586/28988206)。
●一般的に、SLEの家族性集簇持つ多遺伝子相加モデルや、他の自己免疫疾患の家族性集簇が認識されている。
●台湾で行われた全国的な研究では、SLEの相対リスク(RR)は、SLE患者の双子で315.9、兄弟姉妹で23.7、両親で11.4、子孫で14.4、遺伝的類似性のない配偶者で4.4であった(PMID=26193127)。
●一卵性双生児におけるSLEの遺伝的一致率は約25%と推定されている。
●遺伝的に決定された遺伝率は43.9%である一方で、家族と共有された環境因子と共有されていない環境因子はそれぞれ25.8%と30.3%を占めていた。
●SLEに罹患している第一親等親族を持つ個人の様々な自己免疫疾患のRRは、原発性シェーグレン症候群(SS)で5.87、全身性硬化症で5.40、重症筋無力症で2.95、炎症性筋炎で2.77、関節リウマチ(RA)で2.66、多発性硬化症で2.58、1型糖尿病では1.68、炎症性腸疾患では1.39、血管炎では0.86となっている;これらのデータは、罹患者のいる家族へのカウンセリングにおいて有用な指針となる情報を提供し、他の自己免疫疾患との関連性(または関連性がないこと)を理解するための基礎を提供することができる。
●原発性SS、SLE、RAの家族性集簇は、自己免疫性リウマチ性疾患を有する31家族の全ゲノムシークエンシングにより明らかにされている;T細胞受容体シグナル伝達経路におけるまれな遺伝的変異がこの集合体の共通の特徴であるように思われる。
SLEの表現型と診断
SLEの表現型
●主な疾患の特徴と発症時および累積的な頻度を以下に示す(PMID=32106788)。

※ループス腎炎の頻度は昔ほど高くない(主要なループスセンターへの紹介バイアスのためと考えられる)。
※小児ループスは発症時により活動性が高く、より重症化しやすいため、集学的な治療を受けやすい。また長期間臓器障害が蓄積しやすい。
SLEの診断
●診断は、(1)限られた数の特徴が見られる疾患の初期段階、(2)抗核抗体(ANA)陰性の症例や臓器優位型、(3)重症化していて迅速な治療を必要とする稀な疾患の場合には難しいかもしれない。
●筆者らの経験では、非リウマチ専門医の医師は、関節炎を認知しにくく、同時に存在しない疾患の特徴を考慮することが苦手のようである。
●抗核抗体陰性はSLEを除外できない。なぜなら、病気の様々な段階で最大20%の患者が陰性(真陰性または偽陰性)である可能性があるである(典型的なANA陰性ループスはもっと少ないが…※2019年の分類基準によると、抗核抗体80倍未満のSLEは2%前後)。
●その他、(a)一度でも陽性になった抗核抗体を繰り返し検査する事、(b)病状が着実に改善している患者や活動性のない患者での血清学的検査の頻繁な実施、(c)定期的な尿検査を省略する事、は賢明ではない選択である。
●他の慢性疾患と同様に、医師は患者の症状を説明しようとする際に、SLEに関連しない原因を除外することができず、それをSLEのせいにしてしまう傾向がある。
●SLEの多くのmimickerの中で、ウイルス感染症やリーシュマニア症のような寄生虫感染症、リンパ系悪性腫瘍を考慮し、除外する必要がある。
●SLEの診断は臨床的なものであり、様々な臓器の免疫反応や炎症を示す検査データに基づいて行われる。
●3つの分類基準(ACR-1997、SLICC-2012、EULAR/ACR-2019)がある。
※過去にまとめた記事がありますので、ご覧ください。
●それぞれを組み合わせることで、SLEの早期分類が可能となり、重複しない患者群を確実に把握することができる(特異度は低下するが)。
●SLICC-2012およびEULAR/ACR-2019によるSLEの分類には、抗核抗体またはその他の免疫学的な異常(自己抗体陽性または低補体血症)が必要だが、ACR-1997の分類基準は必要ではない。
●分類基準を満たすことはSLEの診断には必要ではない。早期疾患の患者では、SLICCとEULAR/ACRはACRよりも感度が高く、EULAR/ACR基準は特異性に優れている。
●分類基準の優れた性能にもかかわらず、重症化する可能性のある患者は見逃してしまうことがある。
●分類基準を変更することで感度が向上し、より多くの疾患負荷の高い患者さんの早期診断と治療が可能になるかもしれない(下図)。

●この診断アルゴリズムは2019年のEULAR/ACRの分類基準をうまく診断に用いてみようというものです。
●言わずもがな、2019年の分類基準の必須項目には抗核抗体80倍以上がありますが、ここでは抗核抗体が陰性でも低補体血症や抗リン脂質抗体が陽性ならば、抗核抗体の代わりとして良いだろうとしています。
●また、EULAR/ACR分類基準は様々な症状や検査項目を点数化しており、10点以上でSLEと分類するものですが、10点を満たさない場合(免疫学的異常がない場合)でも、臨床スコアが8点以上で、1997年の分類基準に含まれる日光過敏がある場合は臨床的SLEと分類しても良いとしています。
●同様に免疫学的スコアが最低2点、臨床的スコアが最低8点あれば臨床的SLEと診断しても良いとしています。
SLEの分類(エンドタイプ)と臓器優位型SLE
●様々な分類(エンドタイプ)の中で、小児発症SLE(cSLE)、臓器優位型SLE(皮膚、筋骨格系(いわゆる"rhupus")、腎、神経、血液)、抗リン脂質症候群を伴うループス(APS)、シェーグレン症候群は、予後や治療法の違いから、より注目されている(下図)。

●cSLEは既に述べたが、発症時の活動性が高く、重症化しやすく、より積極的な治療を受ける可能性が高く、またダメージを蓄積しやすいとされている。
●APSの存在は、神経精神医学的SLE(NPSLE)、血栓性合併症、産科合併症のリスクを高める。
●筆者らの経験では、原発性APSと思われる患者の3分の1までは、ループス様の症状を呈することがある。
●同様に、特発性血小板減少性紫斑病、溶血性貧血、血清炎、APS、SSと推定される患者は、対照群と比較してSLE発症のリスクが高くなる。
臨床経過、活動性のパターン、予後不良因子
●カナダの大規模なコホートでは、SLE患者の約70%が再発寛解を繰り返し、残りの30%は寛解の長期化と活動性の高い疾患の持続に等しく分かれていた(★PMID=30526328)。

●イタリアではより高い寛解率が報告されており、37%の患者が長期寛解を達成している。なお、血管炎、糸球体腎炎、血液疾患は寛解しない事と関連していた(★PMID=26223434)。
●少なくとも連続2年間の寛解は、臓器のダメージの発生を止めることと関連している(★PMID=28970217)。
●cSLE、男性患者、補体低値、抗DNA抗体や抗リン脂質抗体が陽性の患者、インターフェロン(IFN)シグネチャーが高い患者、活動性指数が中等度から高値の患者は、重症のSLEを発症する可能性が高いとされている(★PMID=20699243)。
●このような患者さんは集学的治療が行われている医療機関に紹介されるのが理想的。
活動性指標と臓器障害指標
活動性指標
●SLEでは多臓器が関与しているため、治療の指針として、また臨床試験のアウトカムとして、グローバルな指標(全般的な指標)と臓器別に検証された疾患活動性指標の両方を使用する必要がある。
●最も広く使われているのは以下の3つの指標。
(1) SLE Disease Activity Index (SLEDAI)
(2) British Isles Lupus Activity Group (BILAG)
(3) Safety of Estrogens in Lupus Erythematosus National Assessment (SELENA)-SLEDAIとPhysician Global Assessment (PGA)
●各指標は、様々な臓器における疾患活動の一般的な徴候や症状をスコア化し、SLEDAIは抗dsDNAや血清補体レベルなどのSLEの血清学もスコア化している。
●SLEDAIは重み付けされているが、BILAGは複数の臓器における軽度、中等度、重度の活動性を包括的に定義しており、intention-to-treatの概念に基づいている(例えば、BILAG Aでは高用量のグルココルチコイドまたは免疫抑制剤の使用が必要)。
●上記の客観的な活動性指標は、疾患活動性の特定の項目を見逃したり、縦断的な変化に対する感度を欠くことがあるため、PGAで補完すべきである。
●筆者らは、SLEDAI-2KバージョンのSLEDAI(新規発症のみではなく、脱毛、粘膜潰瘍、発疹、蛋白尿などの持続的な活動をスコア化できる)とPGAを組み合わせたものと、フレアのためのSELENA-SLEDAIの定義を使用している(下表)。

●新たに提案された SLE Disease Activity Score (SLE-DAS; http://sle-das.eu/ からアクセス可能)は、筋炎、溶血性貧血、心肺、消化器症状など、一般的ではないが重症度の高い症状を含む項目を増やしたもので、高い特異性と使いやすさを維持しつつ、SLEDAI と比較して変化に対する感度が向上している(PMID=30626657)。
※活動性指標については以前にもまとめた記事があるので、ご覧ください。
臓器障害の指標

●SLEでは、SLICC/ACR Damage Index (SDI)(上表)によって評価された臓器障害は、有害な臨床転帰と死亡に関連している。
●SDI項目の定義が曖昧なものもあるが、活動性SLE、行われた治療(特にグルココルチコイド)、または関連する併存疾患による広範囲の臓器の合併症や機能障害をモニターするための唯一の有効で使いやすい臨床ツールである。
●最大スコアは46で、SDIの増加は臨床的にも予後的にも重要であり、疾患の重症度を反映している。
●有効な活動性指標と障害指標の使用は、SLEの管理のためのEULARガイドラインに含まれている。
両指標の計算は以下のオンライン計算機で無料で出来ます。
SLEDAI-2k→https://qxmd.com/calculate/calculator_335/sledai-2k SDI→https://qxmd.com/calculate/calculator_336/slicc-acr-damage-index
アウトカムの指標
●過去30年の間に、少なくとも40種類の新規薬剤を含む後期(IIbおよびIII)の臨床試験は失敗に終わっている。
●メイヨークリニックや米国国立衛生研究所による初期の試験では、臓器別のアウトカム指標(例えば、腎炎など)が用いられていたが、その後の試験では、一般的なSLEの活動性や反応性を把握するためのグローバルなアウトカム指標が用いられている。
●ベリムマブ試験では、患者さんの改善度を判定するために、SELENA-SLEDAI、BILAG、PGAの0~3段階の視覚アナログ尺度を組み合わせた複合指標としてSLEレスポンスンダー指標(SRI)が開発された。
●エプラツズマブの臨床試験データに基づいて開発されたBILAGベースの複合ループス評価(BICLA)では、患者はSLEDAI、BILAG、PGAの3つの評価ツールにわたって奏効基準を満たす必要がある。
●意外と知られていないが、これら2つの複合指標の構造の違いは、最近のSLE臨床試験における奏効率の違いに反映されている。
●疾患の不均一性とその経過、異なる末梢臓器病変と治療に反応するタイミングの不一致、様々な人種や地理的な場所での患者の反応の違い、軽症の患者を含むこと、グルココルチコイドやその他の背景薬の大量投与、そして最後に、臨床試験の組み入れ基準(血清学、バイオマーカーなど)とエンドポイントの欠点により、治療効果の測定基準の改善が必要であり、臓器別のエンドポイントの使用は再考されるべきであると考えるようになってきた。
●これらの注意事項により、最近の臨床試験では、研究者はこれらの問題にもっと注意を払い、それに応じてデザインやアウトカム測定法を変更することを余儀なくされている。
●診断、モニタリング、治療のための分子学的な分類と新規バイオマーカーは利用可能であるが、さらに定義する必要がある。
●例えば、SLE患者の75%がIFNシグナルを持っているのに対し、IFN-a阻害剤に反応する患者は50%に過ぎない(PMID=31851795)。
●寛解やLLDAS(low-disease activity state)のような、より厳密な奏効基準や病状を定義する試みがされている(下記)。

●LLDASは、(a)SLEにおける寛解は望ましいが、常に達成できるわけではないこと、(b)LLDASが観察された時間の50%以上を占める患者では、臓器障害の発生が有意に減少していることを考慮して、実用的で臨床的に適切なアウトカムである(PMID=26458737)。
●フレア(再燃)とは、治療の強化につながる疾患活動性の増加と定義される新しい試験結果である。
SLEのマネジメント
一般原則・治療対象・推奨事項
●管理上の推奨事項は2008年にEULARによって発表され、新たなデータに基づいて2019年に更新された(PMID=30926722)。
※過去にEULAR Recommendation 2019をまとめた記事がございますので、ご覧ください。
●これらの推奨事項はあくまでも指針であり、厳密な指示ではないことに注意すべし。
●治療目標は、患者の長期生存、臓器障害の予防、健康関連のQOLの最適化である。
●治療は、寛解または少なくとも低疾患活動性、および再発の予防を目標とすべきである。
●すべてのループス患者は、実体重5mg/kgを超えない量のヒドロキシクロロキンを投与されるべきである(下図)。


●慢性維持療法中は、グルココルチコイドは7.5mg/日(プレドニゾン換算)以下に最小化し、可能であれば休薬すべきである。
●免疫調節剤(メトトレキサート、アザチオプリン、ミコフェノール酸)を適切に開始することで、グルココルチコイドの漸減/中止を早めることができる。
●活動性が持続している疾患や再燃性疾患では、ベリムマブの追加投与を検討すべきであり、臓器を脅かす難治性疾患では、リツキシマブやシクロホスファミド(CY)の投与を検討すべきである。
●最近のアップデートでは、皮膚疾患、神経精神疾患、血液学的疾患、腎疾患についても具体的な推奨事項が示された。
●SLE患者は、抗リン脂質抗体の状態、感染症および心血管疾患(CVD)のリスクプロファイルを評価し、それに応じて予防戦略を調整する必要がある。
特別な状況
ループス腎炎(LN)
●ループス腎炎(LN)はSLEにおける病的状態、医療費の増加、死亡率の主な原因となっている。
●重度の腎炎の生涯発生リスクは約20%だが、古い報告では過大評価されている可能性がある。若い患者、特に男性、血清学的異常が活発な患者、中等度から重度の非腎性ループスの患者では、腎臓病変のリスクが高くなる(PMID=32220834)。
●組織学的所見に関しては、末期腎臓病(ESRD)への進行の強力な予測因子として、広範な間質性線維化/管状萎縮と半月体の存在が挙げられる(PMID=28473317)(下表)。

●1976年から2016年までの症例を対象としたミラノの単施設研究では、ESRDの危険因子は、男性の性別、高血圧、ベースラインのクレアチニンの増加、高い組織活性と慢性化指標、維持免疫抑制の未使用であった(PMID=29730634)。
●ESRDのない生存期間は20年時点で80%から90%に上昇しており、主に早期の診断生検と免疫抑制療法の迅速な導入に起因している(PMID=29730634)。
※以下にループス腎炎におけるキーポイントを示します。

●2019年版EULAR/European Renal Association-European Dialysis and Transplant Association(ERA-EDTA)のLNに対する推奨事項の更新(PMID=29730634)では、治療目標として、治療開始後3ヶ月目に安定した糸球体濾過率(GFR; ベースライン値の±10%)で蛋白尿を25%以上減少させること、6ヶ月目に蛋白尿を50%以上減少させること、12~24ヶ月目に蛋白尿を0.5~0.7g/24時間未満にすること(いずれもGFRが安定している場合)が設定されている(PMID=32503858)。
●活動的な増殖性LNでは、低用量静注CY(500mg×6回/隔週投与)またはミコフェノール酸モフェチル(MMF; 2-3g/日、または同量のミコフェノール酸)による初期(導入)治療とグルココルチコイド(メチルプレドニゾロン静注、その後プレドニゾロン0.3-0.5mg/kg/日の経口投与)の併用が推奨される。
※プレドニゾロン0.3-0.5mg/kg/日の量はmPSLパルスを併用する事を前提とした量と考えられます。またMMF2-3g/日は日本人では少し多く、1.5-2.0g/日程度が適量と考えられます。
●MMFとカルシニューリン阻害薬または高用量CYの併用は、ネフローゼ領域の蛋白尿と予後不良因子を有する患者には、それぞれ代替レジメンである。その後、MMFまたはアザチオプリンによる長期維持療法を行うべきである。
●グルココルチコイドへの曝露を最小限に抑える必要性がより注目されている。
●EULAR/ERA-EDTAの最新勧告では、メチルプレドニゾロンをパルス静注した後の推奨開始用量は0.3-0.5mg/日プレドニゾロン換算であり、3-6ヶ月までに7.5mg/日以下に漸減されるべきである。
●小児の治療は成人病と同様の原則に従う。増殖性および膜性LNに対するEULARの推奨に基づく治療アルゴリズムを以下に示す。


※ループス腎炎のRecommendationについては以前にまとめておりました。
神経精神ループス(NPSLE)
●NPSLEは血栓性か炎症性かという事が重要。
●神経精神医学的事象は多岐にわたるが、その多くはSLEの診断が下された時に起こる。
●その中でも、痙攣、脳血管障害、認知機能障害が最も頻度が高い。
●虚血性脳卒中のリスクは一般集団と比較して2倍以上であり、SLE診断後1年以内のRRが最も高い(PMID=28400384)。このことは、リウマチ専門医が患者の危険因子をスクリーニングし、早期に介入する機会を提供している。
●重要なことに、脳卒中の約60%は全身性ループスが活動的なときに発生しており、その管理には意味がある。
●症状の大部分は消失するが、健康関連の生活の質の低下や過剰死亡率と関連している(★PMID=31915121)。
※上記文献ではNPイベントの発生率は全SLE中52.3%、SLE診断後の最初の2年間でNPイベントの発生相対リスクは6.16(95%CI, 4.96, 7.66)。初期診断時にNPイベントがなかった患者は10年間のフォローアップでNPイベントを起こさない確率は74%、診断から2年経ってもNPイベントがない場合はその確率は84%に上昇するという情報もあり。
●認知機能障害はSLEにおける重要な問題であり、通常のMRIでは脳の構造的な異常が限られているか、ない場合が多い。
●Barracloughらは、機能的MRIを用いて認知機能の評価を行ったところ、SLE患者では、特にデフォルト・モード・ネットワーク(活動的な思考を行わないときに無意識に脳が行う脳内ネットワーク活動)領域と尾状部において、持続的な注意力を要するタスクのパフォーマンスが低下し、脳の反応が変化していることを示している(PMID=30979715)。
●この研究では、SLE患者は認知パフォーマンスを維持するために代償的な脳メカニズムを用いている可能性が高く、認知の客観的な尺度では健常者と同程度のスコアを得ることができるが、疲労が早くなる可能性があることが強調されている。
●神経精神症状のSLE(いわゆる『原発性NPSLE』)への帰属は複雑であり、(a) リスク(好ましい)因子(症状の種類や発生時期、全身の非神経学的疾患活動の存在、画像や脳脊髄液の異常、抗リン脂質抗体陽性など)、(b) 他の診断を支持する交絡因子を考慮して、他の感染症、悪性腫瘍、併存疾患などのmimicklerを除外するために、包括的で集学的なアプローチが必要となる(PMID=25339643)。
●新しいMRI技術は、原発性NPSLEとループスとは無関係の神経精神医学的事象との鑑別に役立つかもしれない。
●原発性NPSLEは、従来のMRIでは正常に見える脳白質の低灌流が特徴である。筆者らは最近、MRIとダイナミック感受性コントラストMRで測定した脳半球中心部の血流との共登録(co-registration)が原発性NPSLEを示唆していることを示した(PMID=29259047)。
●炎症性と推定されるNPSLEに対しては免疫抑制療法が推奨され、血栓性または塞栓性と推定される症状に対しては抗凝固療法/抗血小板療法が推奨され、両方の機序が可能であると考えられる場合にはそれらの併用が推奨される。
●NPSLE患者(そのうち70%は脳血管障害を起こしており、その多くは全身性ループスの活動性に関連していた)を含む大規模な剖検研究では、微小血栓がNPSLEで特異的に認められ、C4dとC5b-9の沈着と関連していたことから、補体沈着がSLEにおける循環する自己抗体と塞栓性虚血領域との間の相互作用に重要な役割を示している事を示唆している(PMID=28028157)。
●これらの間接的なデータは、特に全身性ループスの活動性があり、抗リン脂質抗体やアテローム性動脈硬化の危険因子がない場合には、脳卒中における免疫抑制治療の閾値を低く設定することをEULARが推奨することを支持するものである。
●以下にNPSLEの管理のためのアルゴリズムを示す。

血液学的疾患
●自己免疫性血球減少症はSLEではよくみられる。
●SLE患者において免疫抑制療法を必要とする血液学的症状には、自己免疫性血小板減少症や溶血性貧血が含まれる。以下にマネジメントについて示す。

●血小板減少症がある場合は、末梢塗抹検査を行い、微小血管症性溶血性貧血(MAHA)と血栓性微小血管症(TMA)を除外する必要がある。
●MAHAは、血管内赤血球の断片化に起因する非免疫性溶血であり、末梢血塗抹中に破砕赤血球を産生する。
●TMAは、古典的な血栓性血小板減少性紫斑病(TTP)などを含む多様な症候群であり、MAHAと動脈血栓症および毛細血管血栓症による臓器障害の両方を特徴とし、病理学的に特徴的な内皮、血管壁の異常を認め、微小血管血栓症を引き起こす。
●すべてのMAHAがTMA症候群によって引き起こされるわけではないが、実質的にすべてのTMAはMAHAと血小板減少症を引き起こす。まれに、MAHAはcatastrophic APSの症状であることがある。
●ほとんどの専門家は、TTPとSLEは別個の臨床症候群であり、共存することは稀であると考えている。
●SLE患者はメタロプロテアーゼADAMTS13値が低下している可能性があるが、これはTTPの古典的な所見であり、このタンパク質に対する自己抗体の存在によるものと考えられている。
●このため、SLEとTTP/TMAの鑑別が困難になり、重度の中枢神経系の病変などの特徴が重なることで、TTPはSLEの増悪と区別がつかなくなることがある;このような場合には、血漿交換やリツキシマブの使用が考慮される。
●しかし、ほとんどの場合、SLEのMAHAは免疫抑制療法に反応し、血漿交換を必要としない。
●マクロファージ活性化症候群(MAS)はSLEのまれな合併症だが、致命的な合併症となる可能性がある。
●MASはSLEの診断と重なることもあれば、SLEの診断後に起こることもあり、10%までの患者で再発する可能性がある。
●高用量のグルココルチコイドのみが第一選択療法として用いられ、免疫グロブリンの静脈内投与、シクロホスファミド、リツキシマブ、エトポシドも使用され、エトポシドとシクロホスファミドを基準としたレジメンが最も効果的である(PMID=28483541)。
肺高血圧症と心病変
●肺動脈性高血圧症はSLEの合併症の一つである。
●最近のデータによると、2つの異なる表現型が示唆されています。それは、ループスの活動性が低い血管障害性(『純粋なPAH』)と、ループスの活動性が高いいわゆる『血管炎性』で、後者は免疫抑制療法に反応しやすい可能性がある(PMID=30232194/30429120)。
●SLE患者は他の機序でも肺高血圧症を発症することがある:肺血管の閉塞が治らないことによる慢性血栓塞栓性肺高血圧症や、低酸素血症を引き起こす間質性肺疾患による二次的な肺高血圧症など。
●心膜炎が最も頻度の高い心臓の症状だが、SLEでは弁膜症やまれに心筋炎がみられることがある。SLEと抗リン脂質抗体の両方が心臓弁膜症のリスクを高める(PMID=30273933/30077990)。
●心筋炎は稀ではあるが、心臓MRIや高感度トロポニン検査の出現により、SLEでの認知度が高まっている。
●抗マラリア薬誘発性心筋症は、抗マラリア薬治療の長期化によるまれな合併症であり、おそらくあまり認識されていない。抗マラリア誘発性心筋症は、伝導異常を伴うか否かにかかわらず、肥大した拘束型心筋症として現れる(PMID=28992800)。
SLE女性の健康、受胎可能性、妊娠
●高悪性度の子宮頸部異形成と子宮頸がんのリスクはSLEの女性では1.5倍にもなる(PMID=24618265)。
●したがって、すべてのSLE女性にヒトパピローマウイルスワクチン接種が推奨される。
●SLEは人間関係や子どもを持つかどうかの判断に影響を与えている。家族計画については、診断後できるだけ早く話し合う必要がある。
●病状が安定していて、血栓症のリスクが低い患者には、経口避妊薬と更年期障害補充療法(強い適応があれば)を行うことができる。

●ほとんどの女性は妊娠を成功させることができ、母体または胎児の有害な転帰のリスクを減らすための対策を講じることができる。
●妊娠に有害な転帰の危険因子としては、活動性SLE、活動性LNの既往または現在の活動性、高血圧または1日1g以上の蛋白尿、血清学的活動性または抗リン脂質抗体の存在、過去の血管疾患および妊娠中の罹患、および活動性疾患の代わりであるプレドニゾンの使用が挙げられる。
●対照的に、ヒドロキシクロロキンおよび抗血小板剤/抗凝固剤の使用は有益である(PMID=26098843)。
●妊娠初期のBbとsC5b-9の増加は、妊娠中の有害な転帰を強く予測し、補体副経路の活性化の役割を支持している(PMID=29371202)。
●最近、多国籍のSLE発症コホートにおいて、妊婦における低用量アスピリンの使用率が低く、子癇前症の危険因子が高いことが報告されており、SLE妊娠中の女性のケアに関する実践と現在の推奨事項との間に大きなギャップがあることが指摘されている(PMID=30573656)。
●先天性心ブロック(CHB)は、SLEを含む抗Ro/SSA陽性女性の胎児の約1%に発症する可能性がある。
●世界規模のレジストリーでは、CHBを持つ人は以下のリスクが有意に高くなっている。(a) 心筋症や心不全、脳梗塞などの心血管疾患の併存、(b) 全身性結合組織障害、(c) 15の一般的な自己免疫疾患のいずれかを発症するリスク(PMID=30808622)
併存疾患
感染症
●SLEにおける感染症の正味のリスクは、疾患関連因子と治療関連因子の両方に関連している。
●患者はEULARの勧告に従って予防接種を受けるべきである(PMID=31413005)。
※これも以前にまとめておりました。
●季節性インフルエンザと肺炎球菌感染症(PCV13とPPSV23の両方)の予防接種は、好ましくは病状が安定している間に行う。帯状疱疹の生ワクチン(Zostavax)による帯状疱疹ワクチンの接種は、一般の人も受けることができる。
●集中的な免疫抑制を受けていない安定したSLE患者90人において、ゾスタバックスは忍容性が高く、免疫反応を誘発した(PMID=31530556)。
●新しい非生ワクチンであるシングリックスは、一般集団での帯状疱疹の予防に安全で効果的だが、ループス患者を対象とした研究は行われていない。
●SLE患者は免疫抑制の状態が変化している可能性があるため、感染が疑われる場合には治療が必要。
●C反応性蛋白の上昇は、細菌感染症の可能性が高いと考えられる(※もちろんそれ以外も考えなければならないが)。
●敗血症の迅速な認識と治療が不可欠。例えば、迅速なSepsis-related acute Organ Failure (SOFA)スコアのような有効なスコアは、3つの変数(精神状態の変化、頻呼吸、低血圧)をスコア化することで、救急室や入院患者の転帰が悪くなるリスクが高い患者を識別する。
心血管疾患(CVD)
●SLEはCVDの独立した危険因子であり、従来の危険因子と疾患関連の危険因子(疾患活動の持続、LN、抗リン脂質抗体の存在、グルココルチコイドの使用など)の両方に起因している。
●スタチンの使用は、脂質値とその他の危険因子の存在に基づいて考慮すべきである。
●10年間のCVDリスクの計算には、例えば系統的冠動脈リスク評価(SCORE)を用いることが推奨されているが、SLE患者では実際のリスクは過小評価されている(PMID=27222591)。
●血圧を140/90mmHg以下に維持することは血管イベントを減少させる可能性があるため、SLE患者の一般的な目標とされている(PMID=32156706)。
●しかし、血圧が130/80 mm Hgを超え、臨床的CVDまたは推定CVDリスクが10%を超える患者は、目標値<130/80 mm Hgまで治療すべきである(PMID=29146535/30165516)。
●さらに、腎疾患を有する患者は、血圧目標値を120/80mmHg以下に下げ、レニン-アンジオテンシン-アルドステロン系阻害剤を使用することで利益を得ることができる(PMID=29730634)。
●台湾の国民健康保険研究データベースの研究では、SLEは経皮的冠動脈形成術(PCI)後の院内死亡率の独立した予測因子であり、全死亡率、血行再建術の再実施、主要な心血管有害事象と独立して関連していた。この研究は、PCIを受けている患者のSLEに内在するリスクを示しており、これらのハイリスク患者に対するケアと二次予防戦略を改善する必要性を強調している(PMID=26286017)。
悪性腫瘍
●SLE患者の悪性腫瘍の割合は一般の人と比べて異なる(PMID=31403485)。
●血液癌、肺癌、甲状腺癌、肝癌、子宮頸癌、外陰腟癌のリスクは高くなるが、乳がんと前立腺がんのリスクは低くなる。
●リンパ腫のリスクは約3倍に増加し、複数の炎症性サイトカインの活性の増加、およびウイルス性の原因の可能性と関連している(PMID=23303389)。
生存・死亡率、収入への影響
●欧米諸国では、SLEと特定の合併症の管理の進歩を反映して、全原因死亡率と原因別標準死亡率は年代とともに有意に減少している。
●しかし、特に40歳未満の患者では死亡率が高くなっている。
●SLEの世界的な状況を見ると、結果はあまり良くない。SLEの生存率は一時的に大きく改善したが、1990年代半ば以降、125件の研究のレビューでは停滞している(PMID=28794077)。
●高所得国では、成人、小児ともに5年生存率は95%を超えているが、低・中所得国では5年生存率と10年生存率は成人よりも小児の方が低かった(PMID=28794077)。
最近の臨床試験
●疾患を改善する従来型の薬剤や生物学的製剤を単独で、あるいは組み合わせて、あるいは順次使用することで、グルココルチコイドの使用を最小限に抑えるなど、治療目標の達成率が向上している。
免疫抑制薬
●より具体的には、MMFまたは腸溶性ミコフェノール酸ナトリウムは、CYと同等の効果があり、アザチオプリンよりも優れていることが研究で示されている(PMID=28450313)。
●カルシニューリン阻害剤をLNの標準治療である導入療法(いわゆる『マルチターゲット療法』)に追加することで、完全寛解率が向上し、寛解が維持される可能性がある。
●最初に試験されたのは、MMFとグルココルチコイドにタクロリムスを併用したレジメンで、導入療法と維持療法の両方に含まれる(PMID=25383558/28760751)。
●AURA-LN第2相試験では、新規カルシニューリン阻害剤であるボクロスポリンの活動性LNに対する有効性と安全性が検証された。
●活動性LNの導入療法としてMMFとグルココルチコイドに加えて投与したところ、優れた腎反応が得られたが、死亡を含む有害事象の発生率が高くなっていた(PMID=30420324)。
●その後に実施された第3相試験では、安全性の懸念なく優れた有効性が確認された。
生物学的製剤
●生物学的製剤に関しては、ベリムマブの有効性に関するこれまでのデータを確認するために、新たな試験が実施された。
●北東アジアのSLE患者さんを対象とした試験では、ベリムマブはプレドニゾンの使用量を減らすと同時に、疾患活動性を有意に改善し、重症化を軽減させた。
●最近の研究では、BLISS長期延長試験でベリムマブを投与された患者さんと、トロントのループスコホートで標準治療を受けた患者さんとの間で、臓器障害の進行度を比較した所、ベリムマブを投与された患者さんは、標準治療群と比較して、1年間に高いSDI(臓器障害)スコアに進行する可能性が61%減少した(HR 0.39)(PMID=30610066)。
●成人の活動性LN患者様を対象としたEfficacy and Safety of Belimumab in Patients with Active LN(BLISS-LN)試験では、448名の患者様が参加し、プラセボと比較して、ベリムマブと標準治療を併用した場合、2年間で統計学的に有意に多くの患者が主要評価項目を達成した(43%対32%、OR(95%CI) 1.55(1.04~2.32))(PMID=32937045)。
●I型IFN受容体サブユニット1に対するヒトモノクローナル抗体であるアニフロルマブは、第3相試験であるTULIP-1試験において、SRI(主要評価項目)に有意な影響を与えなかった。
●一方、TULIP-2第3相試験では、TULIP-1試験の副次評価項目であるBritish Isles Lupus Assessment Group(BILAG)ベースのComposite Lupus Assessment(BICLA)を主要評価項目とした。
●BICLAの奏効には、(1)中等度から重度のベースラインの疾患活動性の低下およびBILAG指標の9つの臓器系のいずれも悪化していないこと、(2)SLEDAIの悪化がないこと、(3)PGAが0.3ポイント以上上昇していないこと、(4)試験介入の中止がないこと、(5)プロトコールで制限された薬剤の使用がないことが必要とされている。
●TULIP-1とTULIP-2の結果の不一致は、SLEに関与する様々な臓器の病態生理の違い、SRIとBICLAの違い(例えば、SRIは完全反応のみをカウントするが、BICLAは部分反応もカウントする)、関与する様々な臓器のそれぞれの重みと血清学の違い(BICLAは血清学を考慮に入れていない)によるものと考えられる(PMID=31851796)。
未解決の疑問、新たなアンメットニーズ、将来の治療法
●SLEは依然として困難で障害のある病気だが、現在では原因の理解が深まり、症状や徴候の早期発見、より効果的で毒性の低い薬剤の開発が進んでいる。
●ベリムマブが承認された後、ループス研究の進展(PMID=21296403/22127708)があり、それぞれが独自の作用機序を持つ治験薬の新たな臨床試験が行われている(下図)。

●これらには、B細胞やT細胞を標的とした抗体、樹状細胞、IFNやその他のサイトカイン、そして最終的には低用量のIL-2を投与してT細胞の機能を制御するものなどが含まれるが、これらに限定されるものではない。
●バリシチニブ試験(PMID=30043749)、アニフロルマブのTULIP-2試験(PMID=31851795)、低用量IL-2試験(PMID=31537547)などの最近の成功は、慎重な楽観視の余地を与えてくれる。
●NPSLEはループスの研究と治療のための新たなフロンティアであり、幅広い臨床症状と複雑な病態生理学的メカニズムを網羅しているが、まだ十分に理解されていない(PMID=31415031)。
●皮膚疾患、神経精神疾患、血液学的疾患、あるいは疲労や頭痛などの症状の治療は依然として問題となっている。
●これらのエンドタイプの分子的、生物学的、画像学的な特徴があるかどうかは明らかではない。
●このため、臓器別のアウトカム指標(例えば、皮膚エリテマトーデスの皮膚エリテマトーデス疾患領域と重症度指標(CLASI)など)を開発することで、異なるサブタイプの疾患に対する薬剤開発が容易になる可能性がある。
【参考文献】
Antonis Fanouriakis, et al. Ann Rheum Dis. 2020 Oct 13; annrheumdis-2020-218272. ”Update οn the diagnosis and management of systemic lupus erythematosus” PMID=33051219
側頭動脈生検陽性GCA vs 陰性GCA vs GCA mimicker~3つのコホートの比較~
巨細胞性動脈炎(GCA)にとって側頭動脈病変の有無を確認する事は非常に重要です。
1990年のACRの分類基準でも『側頭動脈の異常』は一項目となっております。
一方で側頭動脈病変がない大血管型の巨細胞性動脈炎(LV-GCA)も存在します。
こちらは以前にまとめた大血管型の巨細胞性動脈炎のReviewです。
あるコホート研究の報告(PMID=25193809)では側頭動脈病変があるGCAは1990年のACRの分類基準を95%満たしたのに対して、放射線診断的にLV-GCAと診断された患者は39%にしか満たさなかったようです。
LV-GCAは大血管病変が主なので、基本的には生検が出来ません。
では、このようなLV-GCAと側頭動脈病変のある標準的なGCAとでは臨床情報で何が異なるのでしょうか?
今までいくつかのコホート研究が報告されて来ましたが、今回ご紹介するのは、Mayo clinicで実施された3つのコホート研究から、591人の患者を側頭動脈生検陽性群、陰性群、GCA mimicker群に分類し、その臨床的特徴を比較した論文です。
①側頭動脈生検が陽性の患者コホート(2016年, PMID=26385368)
②側頭動脈生検が陰性の患者コホート(1990年, PMID=2202311)
③GCAが疑われたが、別の診断(GCA mimicker)がついたコホート(筆者の施設)
→2009年1月1日から2010年12月31日まで
→GCAが疑われ、生検が陽性、側頭動脈生検陰性のGCAと診断された患者は除外
→最低6か月のフォローアップで違う診断がついた患者を対象
単一施設としては、 最大級の人数で、かつ、GCA mimickerを含めた3群の臨床症状を比較した研究は今までになく、斬新です。
- 患者背景
- 側頭動脈生検陽性GCA患者と陰性GCA患者の比較
- 側頭動脈生検陰性GCA患者とGCA mimicker患者の比較
- 側頭動脈生検陽性GCA患者とGCA mimicker患者の比較
- 生検結果の比較
- 画像所見の比較
- 治療の比較
- アウトカムの比較
- まとめ
- My comments
Results
患者背景

※上記Tableは少し見づらいですが、GCA患者396人(286人は側頭動脈生検陽性、110人は側頭動脈生検陰性)とGCA mimicker患者195人が特定されたようです。
側頭動脈生検陽性GCA患者と陰性GCA患者の比較
●側頭動脈生検陽性GCA患者と比較して、側頭動脈生検陰性のGCA患者では、
-若年(P=0.001)
-初期症状から診断までの時間が短い(p<0.001)
-1990年のACR分類を満たす頻度が低い(p<0.001)。
-リウマチ性多発筋痛症が少ない(p=0.024)
-顎跛行が少ない(p<0.001)
-側頭動脈の異常が少ない(p=0.004)
-上腕の跛行・PMRでない筋骨格痛・食思不振・倦怠感が多い(p<0.001)。
●診断時のESR値は同等だったが、CRP値、血小板、ALPは有意に側頭動脈生検陰性のGCA患者で低かった(p<0.001)。
※側頭動脈生検陰性のGCAの方が診断のまでの期間が短かったというのが意外でした。
側頭動脈生検陰性GCA患者とGCA mimicker患者の比較
●側頭動脈生検陰性GCA患者と比較して、GCA mimicker患者は、
-年齢と性別は類似
-症状の発症から診断までの期間が長い(p<0.001)
-1990年のACR分類基準を3以上満たす頻度が著しく低い(p<0.001 )
●頭痛の発生率は同等だが、GCA mimicker患者の方が非前頭側頭型顔面痛の発生率が高かった(p = 0.001)。
●さらに、GCA mimicker患者では、跛行症状が少なかった。
-顎跛行(p=0.005)
-上腕跛行(p<0.001)
-下肢跛行(p=0.00)
●また検査時の動脈異常も少なかった。
-側頭動脈拍動性の減少(p=0.004)
-大動脈拍動性の減少(p<0.001)
-大動脈のbruit音(p=0.014)
●全身症状もGCA mimicker患者で少なかった。
-食欲不振(p<0.001)
-倦怠感(p<0.001)
- 発熱(p=0.02)
●CRP値は類似していたが、ESR(p=0.002)、血小板(p<0.001)、ALP(p=0.004)は有意にGCA mimicker患者で低かった。
側頭動脈生検陽性GCA患者とGCA mimicker患者の比較
●GCA mimicker患者では女性の割合が低く(61% vs 74%, p=0.002)、非定型顔面痛(p<0.001)、非PMR様筋骨格痛(p<0.001)の頻度が高い。
●GCA mimicker患者ではESR、CRP、ALP、血小板が低かったが、Hb、Albは高かった。
生検結果の比較

●側頭動脈生検前のグルココルチコイドの使用日数の中央値は以下の通り
-側頭動脈生検陽性GCA患者:[0 IQR(0, 4)日]
-側頭動脈生検陰性GCA患者:[3 IQR(0, 7)日]
-GCA mimicker患者:[1 IQR(0, 13)日]
→側頭動脈生検陽性GCA患者では少なかったが、残りの2群は同等。
●片側生検が行われたのは割合は以下の通り
-側頭動脈生検陽性GCA患者:86%
-GCA mimicker患者:76%
-側頭動脈生検陰性GCA患者:66%
●初回の生検検体の長さは、側頭動脈生検陰性GCA患者(14mm)と比較して側頭動脈生検陽性GCA患者で短かった(11mm、p=0.013)。側頭動脈生検陰性GCA患者とGCA mimicker患者では長さは同じだった。
●しかし、2回目の生検検体の長さは側頭動脈生検陰性GCA患者(22mm)と比較してGCA mimicker患者は長かった(32mm, p=0.003)。
※側頭動脈生検陽性患者では生検前のステロイド使用日数が短い事が生検陽性につながった可能性がある事を示唆しているのかもしれません。側頭動脈生検の長さは1.5~2.0cmが良いという研究が最近Lancetから発表されましたが、側頭動脈生検陰性GCAは割と長く生検されているため、側頭動脈をちゃんとした長さ生検して陰性である場合は陰性GCAもしくはGCA mimickerと判断しても良いかもしれません。
画像所見の比較

●少なくとも1つの高度の画像診断法(アンギオ、CTアンギオ、MRIアンギオ、PET-CT)が診断の7か月以内に実施されたのは以下の割合。
-側頭動脈生検陽性GCA患者:72人(25%)
-側頭動脈生検陰性GCA患者:61人(55%)
-GCA mimicker患者:43人(22%)
●大動脈イメージングが実施された側頭動脈生検陽性GCA患者は若年で、四肢跛行症状の頻度が高く、食思不振や体重減少の訴えが多い傾向であった。
●PET-CTは側頭動脈生検陽性/陰性GCA患者よりもGCA mimicker患者でより実施された。
●側頭動脈生検陽性GCA患者の76%、陰性GCA患者の69%で少なくとも1つの異常が認められた。
●壁肥厚は側頭動脈生検陽性GCA患者と陰性GCA患者で同程度で認められ(29% vs 38%)、PET-CTを実施した時の異常なFDG取り込みも同様だった(100% vs 88%)。
●GCA mimicker患者では、血清反応陽性の関節リウマチの病歴を有する1人のみ、限局的なアテローム性動脈硬化症性変化に関連したPET-CTでのFDG取り込みが陰性であった左鎖骨下動脈のわずかな狭窄を示した。それ以外の病的動脈瘤、狭窄、閉塞、肥厚、FDG活性に関連した動脈異常は認められなかった。
※側頭動脈生検の陽性、陰性に関わらず、PET-CTでの壁肥厚やFDG取り込みで診断できる事が多いというのは嬉しいですね。一方でGCA mimickerは有意なPET-CT所見が見られない事で鑑別出来そうですね。
治療の比較
●ステロイドパルス療法(>125mg/日の静注)の割り合いは側頭動脈生検陽性GCA患者と陰性GCA患者で同等(10% vs 9%, p=0.62)。
●1日当たりの初期経口プレドニゾン投与量の中央値(IQR)も同等であった[60mg(40, 60) vs 50mg(40, 60), p=0.12]。
●パルス療法を含む累積プレドニゾン用量の中央値は側頭動脈生検陰性GCA患者よりも陽性GCA患者の方が1年で高かった[6.0g(4.6, 7.7) vs 7.0g(5.6, 8.6), p=0.004]。
→2年、5年時点では両者は類似していた。
・2年:9.1g (7.0, 11.2) vs 8.3g (6.4, 11.3), p=0.47
・5年:11.8g (8.3, 15.2) vs 13.9g (11.6, 15.8), p=0.09


●側頭動脈生検陽性GCA患者は陰性GCA患者と比較して6か月以上プレドニゾン中止率が高った(p<0.001)(上記図A)。
※側頭動脈生検が陰性のGCA患者は大動脈病変が多いと仮定され、大動脈瘤などの合併症を恐れて、ステロイド治療が長くなってしまったのかもしれません…
●6か月以上の中止率は以下(側頭動脈生検陽性GCA患者 vs 陰性GCA患者)
-2年:18±2% vs 9±3%
-5年:49±4% vs 28±5%
-10年:62±4% vs 33±6%
●どの群の患者も経過中にトシリズマブを使用されていなかった。
※用いているコホートが、GCAの治療としてトシリズマブが使用されていなかった時代のもの(※GiACTA試験の結果を受けて、日本や欧米では2017年にトシリズマブがGCAに対して保険適応となった)ですので、仕方ありませんが、もし併用していれば、もう少しステロイドの中止率は高いはずです。
アウトカムの比較
●平均フォローアップ期間は以下の通りで両群で同等。
-側頭動脈生検陽性GCA患者:6.0±3.9年
-側頭動脈生検陰性GCA患者:5.8±4.0年
●総受診回数は以下の通り。
-側頭動脈生検陽性GCA患者:3473回
-側頭動脈生検陰性GCA患者:131313回
●受診回数の中央値は以下で両群で同等(p=0.13)。
-側頭動脈生検陽性GCA患者:19回(13, 27回)
-側頭動脈生検陰性GCA患者:20回(13, 27回)
●少なくとも1回再発した患者数は以下の通り
-側頭動脈生検陽性GCA患者:213/286人(74%)
-側頭動脈生検陰性GCA患者:67/110人(61%)
→患者ごとに追跡期間の長さが異なるため、患者ごとの総再発回数は比較せず、1人年あたりの再発率を計算した所、両群それぞれで1人年あたり再発回数中央値は0.4回(0.2, 0.7回)(p=0.26)。
●初回再発までの時間は両群で有意差なし(下図B)。


●経過中の初回再発の再発率は以下の通り。
-側頭動脈生検陽性GCA患者:1年後 49%(±3)、2年後 68%(±3)、5年後 79%(±3)
-側頭動脈生検陰性GCA患者:1年後 49%(±5)、2年後 64%(±5)、5年後 69%(±5)
●追跡期間中の死亡数は以下の通り。
-側頭動脈生検陽性GCA患者:69例
-側頭動脈生検陰性GCA患者:27例
●死亡率は以下の通り(p=0.59)。
-側頭動脈生検陽性GCA患者:5年後死亡率 14%(±3)、10年後死亡率 31%(±4)
-側頭動脈生検陰性GCA患者:5年後死亡率 16%(±4)、10年後死亡率 34%(±6)
GCA mimickerは以下をご覧ください。
まとめ
●総GCA中、側頭動脈生検陰性のGCAは15.3%(PMID=11182025)~28%(本研究)。
-若年(P=0.001)
-初期症状から診断までの時間が短い(p<0.001)
-1990年のACR分類を満たす頻度が低い(p<0.001)。
-リウマチ性多発筋痛症が少ない(p=0.024)
-顎跛行が少ない(p<0.001)
-側頭動脈の異常が少ない(p=0.004)
-上腕の跛行・PMRでない筋骨格痛・食思不振・倦怠感が多い(p<0.001)。
-CRP値、血小板、ALP値が低い(p<0.001)
●GCA mimickerは側頭動脈、大動脈拍動性低下などの動脈異常の割合が低く、顎跛行、四肢跛行などの跛行症状の頻度が低い上、ALP値、血小板も低い。
●側頭動脈生検の陽性、陰性に関わらず、PET-CTでGCAは壁肥厚とFDG取り込みが見られ、診断に有用である。一方で、GCA mimickerはPET-CTであまり有意な所見を呈さない事で鑑別できる。
●側頭動脈生検の陽性、陰性の治療は同程度だったが、側頭動脈生検陰性のGCAはステロイドを中止するのに時間がかかる傾向が見られた。
●側頭動脈生検の陽性、陰性の再発率、再発までの期間はそれほど変わりなし。
My comments
●全く異なるコホート3つを比較検討する手法は斬新でした。単一施設だからこそ成せる技でしょう。
●側頭動脈生検陽性GCAと陰性GCAでは症状、炎症の程度の差こそあれど、治療や予後に関してはそれほど差がないのだと分かりました。ただ、トシリズマブを使用したデータがなかったので、そこは少し残念…多分今後データを出して来ると思いますが。
●もちろん、『側頭動脈生検陰性の中には偽陰性の患者さんも紛れている』可能性、は否定できませんが、生検している長さがむしろ陽性GCA患者よりも長いのでだし、偽陰性の可能性は下がる、と個人的には思います。
●GCAと比べて、GCA mimickerは跛行症状がない、動脈異常所見がないなど、問診、身体所見である程度当たりを付けられる、というなんとも日常診療にとっては前向きな結果でした!
●どうしてもわからないときは『PET-CT様』に助けてもらうという事は変わりませんね。PET-CTでFDGの集積があれば、側頭動脈生検が陰性でも、ACR1990年分類基準を満たさなくても、GCAと診断できるかもしれないし、GCA mimickerでは所見がない事が多いので、除外もできます。
【参考文献】
Matthew J Koster, et al. Semin Arthritis Rheum . 2020 Jun 17;50(5):923-929. "Giant cell arteritis and its mimics: A comparison of three patient cohorts" PMID=32906026
軽症のSLEはどれくらい重症化するか?
様々な薬剤が登場してきたおかげで全身性エリテマトーデス(SLE)患者さんの生命予後は著明に改善しました。現在では生命予後の改善から生活の質(QOL)の改善へ目標が移行して来ていると言っても過言ではありません。
しかし、生命予後は改善しているものの、重症病型がなくなったわけではありませんし、軽症と考えていた患者さんが重症病型に移行する事もあります。
どんな患者さんが、どのくらい重症化するかは臨床医にとってとても関心のある情報ですが、データが不足しています。最近、軽症のSLE患者さんがどれくらい重症に移行するかについて研究した報告がありましたので、ご報告します。
Patients & Methods
●ギリシャ(アテネ)のAttikon大学病院(三次医療センター)からの報告。
●Attikon lupusコホートに含まれる罹病期間が1年以上の462人のSLE患者さんを対象。
●対象期間は2014年1月から2019年1月。
●SLEはACRまたはSLICCの分類基準を満たすものとした。
●ループス腎炎はSLE分類基準または腎生検に従って分類された。
●NPSLEはACRの定義を用いて、二人の専門医師(DTB, AF)が分類した。
●神経精神症状が発症した後にコホートに登録された患者の場合、症状がSLEに起因するかどうかは病歴、リスク因子(抗リン脂質抗体、以前の神経精神症状、全身の疾患活動性)などを参考に判断した。
●小児発症SLEの年齢のカットオフ値は17歳とした。
●晩期発症SLEの年齢のカットオフ値は50歳とした。
●重症度は初診時と最終診察時の2つのポイントで(1)BILAGと(2)治療内容によって軽症、中等症、重症に分類された。
●重症:(1)BILAGで少なくとも1つの臓器の重症症状
(2)疾患の経過中の任意の時点でシクロホスファミドまたはリツキシマブ
(関節炎以外の症状に対して)を使用
●軽症:(1)BILAGで軽症
(2)主要な臓器病変がない
(3)最大の治療が経口グルココルチコイド≤10mg/日(PSL相当)または筋注
ヒドロキシクロロキン
●中等症:軽症と重症の間
●重症のループス腎炎は除外されている。
Results
患者背景

●総患者数462人、診断時平均年齢37.3(SD 15,2)歳、女性:男性=9:1
●最終フォローアップまでの中央期間は36(IQR 120)か月。
●50人(10.8%)が小児発症SLE、98人(21.2%)が晩期発症SLEと診断された。
●最も多い症状は炎症性関節炎(72.7%)、次いで急性皮膚ループス(63.2%: 主に蝶形紅斑、日光過敏)、白血球減少(22.5%)、非瘢痕性脱毛症(22.5%)。
●ループス腎炎は44人(9.5%)の患者で発症時に出現したが、61人(13.2%)の患者が追跡中に腎障害を発症し、全体の有病率は22.7%に達した。
●86人の患者(18.6%)で112の神経精神症状を認めた。
●NPSLE患者の約60%(86人中51人)は診断時に少なくとも1つのSLE関連の神経精神症状を呈しており、35人(39.7%)の患者はフォローアップ中にNPSLEを示した。
※診断時の症状で多いのは関節炎、蝶形紅斑、日光過敏あたりのようです。ループス腎炎やNPSLEはこのコホートでは10人に1人ぐらいの頻度の様です。診断時の白血球減少は2割、低補体価は4割、抗ds-DNA抗体/抗Sm抗体/抗リン脂質抗体の陽性率は5割弱のようです。検査所見はあまり過信してはいけません。

●治療に関してはヒドロキシクロロキンが95%、経口グルココルチコイドが98.3%。
時間経過に伴う重症度の推移

●最初に軽症と分類されたのは患者の56.5%(261/462人)。
●最終的にその中で50.2%(131/261人)が軽症と分類され、残りは重症度が変化した。
→29.1%(76/261人)が中等症、20.7%(54/261人)が重症へと変化した。
●最初に中等症と分類されたのは23.6%(109/462)人。
→最終的に29.4%(32/109人)が重症へ変化した。
●最初に重症と分類されたのは19.9%(92/462人)。
軽症から中等症へ移行する予測因子

●最初に軽症と分類された患者261人が中等症へ移行する予測因子を解析。
●単変量解析、多変量解析の両方で罹病期間、抗ds-DNA抗体陽性が中等症へ移行する事に関連していた。
●単変量解析のみ有意だが、晩期発症SLEでは中等症へ移行しにくい傾向が見られた。
軽症・中等症から重症へ移行する予測因子

●最初に軽症または中等症と分類された患者が重症へ移行する予測因子を解析。
●多変量解析では男性(OR4.53, 95%CI1.23~16.60)、罹病期間(OR1.09, 95%CI1.04~1.14)、初発時の神経精神症状(OR6.33, 95%CI1.11~32.67)が重症への移行に関与していた。
●抗ds-DNA抗体はわずかに統計的有意差が見られなかった。
●単変量解析のみ有意だが、晩期発症SLEでは重症へ移行しにくい傾向が見られた。
小児発症・晩期発症SLEの重症度の推移
●小児発症SLEはループス腎炎での発症が一般的に2倍であった(42% vs 20.6% p=0.001)。
●小児発症SLEでは最終的に重症への移行が54.1%であったのに対して、晩期発症SLEでは43.6%であった(統計的有意差なし)。
●重症度、SDI、主要臓器病変のパターンに関して両群で有意差なし。
●晩期発症SLEでは診断時の中等症/重症の割合が多く(56.2% vs 40.3% p=0.005)、より重症へ移行する割合が低かった(19.7% vs 50.7% p<0.001)。
※晩期発症SLEが重症へ移行する割合が低いのは、最初から重症が多いからなのかもしれません。
経過中の臓器障害の発生
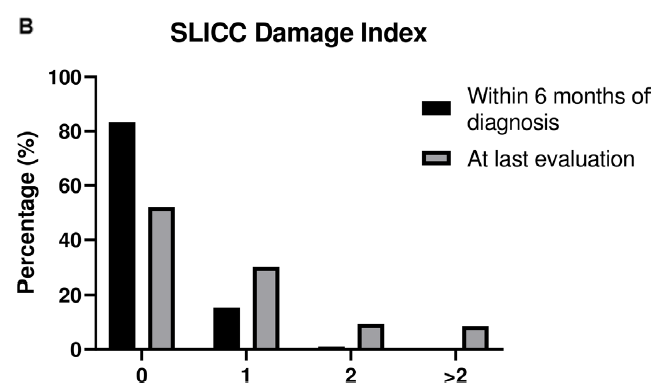
●16.5%(76人)の患者では診断から6か月以内に何らかの臓器障害が確立していた(上記図のSLICC Damage Indexが1以上の割合)。
●以下に6か月以内に臓器障害に至ったSLE患者の初発時の症状を列挙する。
神経精神症状や血栓症が多かった。

●なお、罹患期間の中央値3年を経ても、52.2%(241人)の患者はまだ臓器障害を受けていなかった(SDI=0)。
●ただし、3年を経ると、8.6%(40人)の患者では臓器障害度数が高値であった(SDI>3)。
臓器障害の予測因子

●臓器障害発生の予測因子を評価するために単変量解析、多変量解析が行われた(n=462)。
●単変量解析で臓器障害発生予測に有意な項目は高血圧症、脂質異常症、肥満などの併存疾患だったが、多変量解析では診断年齢、特に罹患期間、重症度の変化が臓器障害発生予測因子として挙げられた。
●抗リン脂質抗体陽性も臓器障害発生のリスクとなり得る。
重症度の移行と臓器障害の関係

●罹病期間が3年未満でも重症度の移行(より重症に移行)がある場合は臓器障害の発生リスクが高いが、罹病期間が3年以上の患者では、重症度がより重症に移行した場合、臓器障害のリスクは23倍になる。
まとめ
●60%の患者が軽症で発症するものの、その内の約50%が中等症や重症に移行する。
●罹病期間が長い患者、抗ds-DNA抗体陽性例では軽症で発症したとしても中等症へ移行するリスクあり。
●男性、罹病期間が長い患者、初発症状が神経精神症状の場合、軽症や中等症で発症したとしても重症へ移行するリスクあり。
●晩期発症SLEは診断時の中等症/重症の割合が多く、より重症へ移行する割合が低い。
●小児発症SLEは54.1%が重症へ移行する。
●52.2%の患者は3年経過しても臓器障害が発生しない。
●罹患期間が長い患者、重症度の変化がある患者は臓器障害発生のリスクがある。
●神経精神症状、血栓症が初発症状の場合、6か月以内に臓器障害を起こす可能性がある。
My comments
●”60%の患者が軽症で発症するものの、その内の約50%が中等症や重症に移行する”というのは、驚きの数字です。ただし、このコホートはギリシャの白人を対象とした研究なので、日本で同じ事が言えるかどうかは分かりません。日本のデータは当施設から出そうと思います。
●また重症度をBILAGで行っている点も注意が必要です。疾患活動性の評価には様々な指標がありますが、これが最も良い!と断定できるものはなく、どれも一長一短のような気がしますが、一般的にはSLEDAIを用います。今回使用されたBILAGは86項目を評価するので、外来で実施する事は難しいのではないでしょうか…
●ただし、これだけ重症度が変化する可能性がある事が分かったので、プライマリでSLEかな?と思われた患者さんは是非専門医にご紹介下さい!!。
●どのくらいで中等症や重症に移行するのか、期間の情報がもう少しあっても良いかなと思いました。
●あともう少し長期(少なくとも5年)の重症度の変化の追跡は必要かと思いました。
【参考文献】
Dionysis S Nikolopoulos, et al. Lupus Sci Med . 2020 Jun; 7 (1): e000394. "Transition to severe phenotype in systemic lupus erythematosus initially presenting with non-severe disease: implications for the management of early disease" PMID=32601172
関節痛を起こすリウマチ膠原病関連疾患の鑑別アルゴリズム
一般内科医のための関節痛を訴える関節リウマチ、全身性エリテマトーデス、脊椎関節炎、変形性関節症の鑑別のためのアルゴリズムが公開されていたため、以下にお示しします。
いくつか気になるところもありますが、一般的な慢性関節痛を起こすリウマチ膠原病関連疾患の鑑別のご参考になれば幸いです。

【参考文献】
Daniel G Fernández-Ávila, et al. Clin Rheumatol . 2020 Aug 25. doi: 10.1007/s10067-020-05323-w. Online ahead of print. "Design of an algorithm for the diagnostic approach of patients with joint pain" PMID=32840702