味覚障害の鑑別疾患
味覚障害の鑑別も色々あります。こういうのは家庭医の先生の方が得意なのではないでしょうか。プライマリケアでかなり見ていそうです。
【嗅覚障害を起こすウイルス】
【嗅覚障害のウイルス以外の鑑別疾患】
【味覚障害の鑑別疾患】

【参考文献】
●Malaty J, et al. Am Fam Physician. 2013 Dec 15; 88 (12): 852-9. "Smell and taste disorders in primary care."
●Bromley SM, Am Fam Physician. 2000 Jan 15; 61 (2): 427-36, 438. "Smell and taste disorders: a primary care approach."
嗅覚障害の鑑別診断~ウイルス以外~
嗅覚障害を起こすウイルスについて前回書きましたが、ウイルス以外にもこんなに嗅覚障害を起こす病気があるんですね。
【嗅覚障害を起こすウイルス】
【嗅覚障害の原因】

【参考文献】
●Malaty J, et al. Am Fam Physician. 2013 Dec 15; 88 (12): 852-9. "Smell and taste disorders in primary care."
●Bromley SM, Am Fam Physician. 2000 Jan 15; 61 (2): 427-36, 438. "Smell and taste disorders: a primary care approach."
嗅覚障害を起こすウイルス
世間ではコロナウイルスが嗅覚障害を起こす事が話題となっておりますが、
ウイルス感染症はもともと嗅覚障害を起こす最も頻繁な原因。
報告にもよりますが、ウイルス感染症の2~4割前後に嗅覚障害が起こります。
嗅覚障害を起こす可能性があるウイルスは200種類以上ありますが、
日本の報告では、以下のウイルスが嗅覚障害を起こした患者から同定されました。

※この中で一番多いのはライノウイルスです。風邪の代表的なウイルスですね。
※コロナウイルスももともとは風邪の代表的なウイルスです。
その他にも、
・コクサッキーウイルス
・エコーウイルス
・パラミキソウイルス
・RSウイルス
・単純ヘルペスウイルス
・水痘帯状疱疹ウイルス
などのウイルスが嗅覚障害を起こす可能性があります。
嗅覚障害があるからと言ってすぐにコロナウイルスと考えなくても良いでしょう。
症状が嗅覚障害だけであれば、うがい、手洗い、マスク、自宅待機を徹底しましょう!
【参考文献】
●Suzuki M, et al. Laryngoscope. 2007 Feb; 117 (2): 272-7."Identification of viruses in patients with postviral olfactory dysfunction."→日本からの報告
●Seiden AM, Otolaryngol Clin North Am. 2004 Dec; 37 (6): 1159-66."Postviral olfactory loss."→ウイルス感染後嗅覚障害のReview
OMAAVという病気を知っていますか?
OMAAVという病気をご存知でしょうか?
ANCA関連血管炎が原因で起こる中耳炎のことで、
Otitis media with antineutrophil cytoplasmic antibody assiciated vasculitis
の略語になります。
比較的最近出てきた概念で、抗菌薬や鼓膜換気チューブなどといった標準的な治療を行っても改善しない難治性の中耳炎の中で、ANCA関連血管炎が原因と考えられた症例が報告されて来ておりました。
本日はOMAAV(オマーヴ)について、日本からの2016年の全国調査のコホート研究をご紹介したいと思います。
ANCA関連血管炎のマネジメントについてのReviewはこちらをどうぞ。
Introduction
●ANCA関連血管炎の中でも中耳炎は多発血管炎性肉芽腫症(GPA)患者の30~50%に合併する。
●またGPAだけでなく、MPAやEGPAによる中耳炎患者は顔面麻痺や肥厚性硬膜炎を合併する事が報告されている。
●ANCA関連血管炎に伴う中耳炎はOMAAVと称され、以下の典型的特徴を有する。
1. 抗菌薬や鼓膜換気チューブに反応しない滲出液や肉芽を伴う難治性中耳炎
2. 中耳の滲出液や肉芽が原因で徐々に進行する難聴が、2か月以内に急激に進行する
3. ほとんどがMPO-ANCAまたはPR3-ANCA陽性
4. 顔面麻痺や肥厚性硬膜炎を伴う
●この疾患は比較的稀であり、診断が難しい事が多いため、大規模コホートは今までなかった。
●本研究では①顔面神経麻痺や肥厚性硬膜炎との関係性、②再発や予後不良の経過の要因、③初期治療で何が有効か、などについて日本国内で全国調査を実施し、OMAAV235例の臨床的特徴を解析した。
Patients and Methods
患者
●2013年12月から2014年2月にOMAAVに関する全国調査(アンケート)を実施。
●1回目のアンケートで過去10年間のOMAAV患者経験数を尋ねた。
●2回目のアンケートは、少なくとも1名のOMAAV患者を評価したことのある施設に電子メールで送付し、初期症状、病変部位、ANCAの状態、聴力データ、画像データ、局所所見、病理所見、治療法、臨床経過など、各患者に関するより詳細な情報を得た。
●関連する臨床情報およびフォローアップデータは、すべての症例について病院のカルテから取得した。
OMAAVの定義
●以下のA、B、Cの全てを満たす場合にOMAAVと分類した。
A: 抗菌薬や鼓膜換気チューブに抵抗性の滲出液または肉芽形成を伴う難治性中耳炎
B: 次の内、少なくとも1つが陽性
(1)血清MPO-ANCAまたはPR3-ANCAが陽性
(2) ANCA関連血管炎に一致する病理組織所見
①壊死性血管炎
②肉芽の有無に関わらず、小動脈優位に炎症を認める
(3)耳以外のANCA関連血管炎の病変
→眼、鼻、咽頭・喉頭、肺、腎臓、顔面神経麻痺、肥厚性硬膜炎、その他
C: 他の疾患の除外
難治性中耳炎
・細菌性中耳炎
・コレステロール肉芽腫
・コレステリン腫
・悪性骨髄炎
・結核
・悪性腫瘍
・好酸球性中耳炎
自己免疫性疾患・血管炎
・コーガン症候群
・結節節性多発動脈炎
・その他の自己免疫性疾患
ちなみに、2016年の日本耳科学会のOMAAV診療の手引きでは以下の定義

寛解・再燃の定義
●寛解は、3か月間ANCA関連血管炎に起因する症状が認められない状態と定義。
●再燃は寛解後、新たな病変の発生、または臨床的血管炎の症状の再発、悪化と定義。
血清ANCA
●血清MPO-ANCAとPR3-ANCAは酵素結合免疫吸着法(ELISA)、化学発光酵素免疫測定法(CLEIA)、または蛍光酵素免疫測定法(FEIA)の3つの酵素免疫測定法のいずれかによって測定した。
聴力検査
●聴力は定期的に純音オージオメトリで評価され、0.5、1、2kHzのしきい値の3音平均(算術平均)を用いて算出された平均聴力レベルで表された。
●完全難聴は、いかなる音でも検出不能な聴力レベル(105dB以上)の感音性難聴と定義した。
●聴力の転帰は、有意な回復(CR)、部分回復(PR)、非回復(NR)の3つに分類された。
●聴力の改善率は、全患者数に対するCRとPRの患者数の割合(%)で表した。
統計解析
●2群比較は、Wilcoxonの符号付き順位検定、Mann-Whitney U検定、カイ二乗検定、またはFisherの厳密検定を用いて検定された。
●3群比較は、Ryanの多重比較法またはSteel-Dwass検定を用いて検定した。
●関連因子の決定のために、一変量解析で選択された臨床変数を多変量ロジスティック回帰モデルに同時に入力した。
●Ryanの多重比較法はR統計ソフトウェアを使用し、その他はJMP® 11(SAS Institute Inc., Cary, NC)を用いた。
●統計的検定は、p<0.05の有意水準に基づいて行った。
Result
患者
●123施設のうち70施設が少なくとも1人のOMAAV患者を経験したことがあると回答し、合計で235人の患者が登録された。
●男性64人(27%)、女性171人(73%)、年齢の中央値は68歳(26~89歳)
●追跡期間は7~144か月、全患者の中央値は24か月。
臨床症状と障害臓器
●OMAAVの代表的な所見を以下に示す。

図: OMAAVの代表的な臨床所見。
(A) 右鼓膜が赤みを帯び、粘液性の滲出液で満たされているように見える。
(B) 側頭骨のCT画像。右中耳と乳様体腔には軟部組織物質が充填されている(矢印)。
(C,D) 肥大性硬膜炎のGd造影MRI。硬膜は両側幕状骨に沿って肥厚し(矢頭; C)。
右側頭葉の下側面には右翼状骨頂上の隆起した腫瘤(矢印D)が侵入している。
(E, F) 肥大性硬膜炎を伴う生検標本の顕微鏡写真。リンパ球浸潤、好中球の破片、コラーゲン壊死とともに、間質の肉芽腫性病変が見られる(120x; E)。リンパ球や形質細胞の浸潤に多核巨細胞(矢印; F)がみられる(360x; F)
●235人の患者の臨床的特徴を以下に示す。

●耳症状は全例で見られた。初めに中耳の滲出液や肉芽による難聴が徐々に進行し、その後、内耳障害による急激な進行性の難聴が見られた。
●その他、頭痛(26%)、顔面麻痺(22%)、肥厚性硬膜炎(17%)が見られた。
●CTでは231人中218人(94%)に骨びらんを伴わない中耳または乳突蜂巣が内容物で充填されていた。
●147人の患者で中耳またはその他の部位からの生検が得られたが、39人(27%)はANCA関連血管炎の病理組織(肉芽腫の有無に関わらず、小血管に優位に起こる壊死性血管炎)を認めた。残りの108人(73%)は炎症性肉芽のみであった。
血清ANCA値
●ANCAは232人の患者で得られた。
-MPO-ANCA陽性: 140人(60%)
-PR3-ANCA陽性: 45人(19%)
-両方とも陽性: 10人(4%)
-両方とも陰性: 37人(16%)
●最初にANCAが両方とも陰性だった5人の患者のうち、4人がMPO-ANCA陽性、1人がPR3-ANCA陽性に転化した。
聴力検査
●初診時に234人の患者の401個の耳について聴力測定データが得られた。
●結果、聴力レベルは10個の耳で正常、35個の耳で伝導性難聴、314個の耳で混合性難聴、42個の耳で感音性難聴が認められた。
●完全難聴は9個の耳で片側性に、8個の耳で両側性に認められた(4人)。
●伝音性難聴、混合難聴、感音性難聴の群の平均聴力レベルを以下に示す。各難聴毎の空気伝導聴力レベルと骨伝導聴力レベルの中央値と、括弧内に25~75パーセンタイルを示す。
・伝音性難聴: 32(28~47)dB、14(12~18)dB
・混合性難聴: 75(59~90)dB、48(35~58)dB
・感音性難聴: 114(47~115)dB、73(49~73)dB
治療と臨床経過
●226人の初期治療データが得られた。
●コルチコステロイド(経口PSL106人、mPSL静注16人)と免疫抑制薬を併用した122人(54%)とコルチコステロイド単独(経口PSL90人、mPSL静注14人)の104人(46%)の2群に分けられた。
●PSLの経口投与量は10~80mgで初期治療の中央値は40mgであった。
●免疫抑制薬はシクロホスファミド97人(POCY69人、IVCY28人)、アザチオプリン11人、メトトレキサート6人、シクロスポリン3人、タクロリムス3人であった。
●残りの5例と4例はそれぞれ、治療希望なしと治療法の選択肢を知らない患者であった。
●臨床経過中に41%の患者が再発した。以下に症状と経過を示す。
・両側完全難聴: 6%
・顔面麻痺: 36%
・肥厚性硬膜炎: 28%
・咽喉頭病変: 5%
・肺病変: 35%
・腎臓: 26%
・その他の血管炎に関連する症状: 37%
●4人(2%)が死亡し、3人が疾患関連死(全てくも膜下出血)、1人が治療関連死(心不全)であった。
ANCAに応じた臨床的特徴

●上記より、MPO-ANCA陽性例では、最も年齢が高く(70歳、p<0.001)、PR3-ANCA陽性例では鼻(64%、p<0.001)と肺病変(51%、p<0.01)が多かった。
●MPO-ANCA、PR3-ANCAが両者とも陰性例では治療前の症状の期間が最も長く(8.0か月、p<0.05)、肥厚性硬膜炎(54%、p<0.001)と疾患関連死の発生率(8%、p<0.01)が最も高かった。
罹患病変、再発、生存による臨床的違い

●顔面麻痺と肥大性硬膜炎を有する患者と有さない患者の比較を上記に示す。
●顔面麻痺のある患者は、ない患者に比べて、頭痛(35% vs 21%、p<0.05)、肥大性硬膜炎(35% vs 24%、p<0.05)の発生率が有意に高かった。
●肥大性硬膜炎患者は、ANCA陰性(32% vs 10%、p<0.001)、耳鳴(67% vs 46%、p<0.01)、頭痛(48% vs 18%、p<0.001)、顔面麻痺(47% vs 33%、p<0.05)の割合が有意に高かったが、肺病変(19% vs 41%、p<0.01)、腎病変(11% vs 24%、p<0.05)の割合が低かった。
●多変量解析により、以下が肥大性硬膜炎と関連する有意な独立因子と判明した。
・頭痛(OR=3.73、95%CI=1.87~7.56、p=0.0002)
・耳鳴(OR=2.37、95%CI=1.21~4.80、p=0.01)
・両ANCA陰性(OR=3.31、95%CI=1.49~7.44、p=0.004)
●年齢、性別、ANCAの種類、初期症状、顔面神経麻痺、肥大性硬膜炎、その他の病変は、疾患の再発に影響を及ぼさなかった。
●2群比較解析では有意差は認められなかったが,コルチコステロイドと免疫抑制剤を併用した患者(122人中45人、36%)は、コルチコステロイド単独投与患者(101人中47人,47%)と比べて再発率が低かった。
●多変量解析で、コルチコステロイド+免疫抑制剤療法は、疾患の再発がないことの独立した予測因子であることが確認された(OR=1.90、95%CI=1.07~3.42、p=0.03)。
●年齢、性別、耳痛、耳漏、めまい、頭痛などの初期症状、肺や腎病変は患者の死亡率に影響を与えなかった。
●しかし、疾患関連死を呈した3人の患者はいずれも疾患の再発(p<0.05)を経験し、ANCA陰性(p<0.01)、顔面麻痺、肥大性硬膜炎(それぞれp<0.01)を示した。
聴力の予後
●220人の患者(男性60人、女性160人、年齢中央値68歳)の計381個の耳について、追跡期間中央値24ヶ月の聴力予後が得られた。
●転帰は152個の耳でCR(40%)、119個の耳でPR(31%)、110個の耳でNR(29%)に分類された。
●両側性完全難聴は14例(6%)に認められた。聴力改善率は71%であった。
●フォローアップ期間、年齢、性別、ANCAの種類、耳漏、めまい、頭痛などの症状、肺や腎病変は聴力に影響を与えなかった。
●初診時の聴力レベルに差はなかったが、聴力改善率は、顔面麻痺のある患者では、ない患者と比べて、有意に悪化していた(53% vs 67%、p<0.01)。
●肥大性硬膜炎のある患者でも、ない患者と比べて、聴力改善率は有意に悪化していた(55% vs 65%、p<0.05)。
●聴力データと治療データの両方が374個の耳で得られた。
●201個の耳(54%)にはコルチコステロイドと免疫抑制剤の併用療法が、173個の耳(46%)にはコルチコステロイド単独療法が行われた。
●治療前の聴力レベルに差はなかったが、聴力改善率は、コルチコステロイド+免疫抑制剤併用療法を受けた耳で有意に良好であった(68% vs 56%、p<0.01)。
●多変量解析により、コルチコステロイドと免疫抑制剤の併用療法が聴力改善の独立した予測因子であることが確認された(OR=2.58、95%CI=1.56~4.32、p=0.0002)。
ANCA関連血管炎の基準による分類
●一般的なANCA関連血管炎の診断基準は厚生労働省1998年版(JMHLW)と欧州医薬品庁(EMEA)のアルゴリズムがある。
●JMHLWの基準によると、本研究の235人の患者はEPGA 3人(1%)、MPA 22人(9%)、definite GPA 43人(18%)、probable GPA 134人(57%)に分類された。
●残りの33人(14%)はPR3-ANCAが陰性で(27人はMPO-ANCA陽性だったが)、組織学的な証拠がなく、上気道(耳、鼻)以外の障害部位がなかったため、GPAの基準を満たさなかった。
●EMEAの基準によると、本研究の235人の患者はEPGA 3人(1%)、MPA 22人(9%)、GPA 183人(78%)と分類された。残りの27人(12%)は分類基準の項目である組織学的証明、ANCA、血管炎や肉芽腫を強く示唆する特異的検査のうち、少なくとも1つ以上を満たしていなかった。
Discussion
●本研究ではJMHLWとEMEAの基準を満たさない症例がそれぞれ33人(14%)、27人(12%)であり、これはRemIT-JAV試験とほぼ同率であり、これらの基準がOMAAVにも適応が出来ると思われる。
→しかし、これは235人の大多数が顔面神経麻痺や肥厚性硬膜炎、肺や腎病変などの病状の進行により基準を満たしていたことに起因する。
●ANCA陽性でだが、耳以外の病変を示さず、組織学的に証明されていない初期のOMAAV患者についてはJMHLWやEMEA基準では診断出来ない。
→実際そのような患者は初診時に235人中41人(17%)見られた。過去の報告(Clin Exp Nephrol. 2013;17:663–6./Ann Rheum Dis. 2010;69:1934–9.)では上気道に病変が限局している患者の半数がANCA陰性であり、生検検体中に組織学的血管炎が含まれるのも3分の1であり、上気道限定型ANCA関連血管炎の診断基準が必要である。
●今回の研究ではGPA,MPA、EGPAに分類された患者では臨床的特徴に差がなかった。
→ANCA関連血管炎のサブグループ間での鑑別は困難であるため、ANCA関連血管炎による難治性中耳炎には適応できない。
●併存症としては顔面麻痺(初診時22%、全経過36%)、肥厚性硬膜炎(初診時17%、全経過28%)、肺病変(35%)、腎病変(26%)が多い。
●顔面麻痺はGPA患者の5~8%に起こると報告されており、肥厚性硬膜炎はGPAでは0.6%(Ann Neurol. 1993;33:4–9.)から6.7%(Arch Neurol. 1969;8:145–55.)認めるという報告がある。
●YokosekiらはANCA関連血管炎による肥厚性硬膜炎21人のうち、66%に中耳炎が見られたのに対して、肺、鼻、喉頭、腎臓病変はそれぞれ、29%、10%、0%、10%しか認めていないと報告している(Brain. 2014;137:520–36.)。
●ANCA陽性の肥厚性硬膜炎100例のデータでも初発部位は耳(49%)が最多で次いで、眼(27%)、腎臓(7%)、鼻(3%)、肺(1%)となっている(データ未公表)。
●これらから、顔面麻痺と肥厚性硬膜炎はOMAAVの特徴的な症状と考えられる。
●これは中耳と顔面神経、硬膜が解剖学的に隣接しているためと考えられる。
●炎症性肉芽が直接顔面神経管に沿って広がって破壊し、顔面麻痺を起こす事がある(Allergol Int. 2014;63:523–32.)。
●中耳の静脈は硬膜静脈と交通しているため、炎症が直接硬膜に広がる可能性がある(Brain. 2014;137:520–36.)。
●頭蓋底の肥厚性硬膜炎は脳神経VIIIに直接影響を与え、不可逆的な蝸牛性感音難聴を引き起こす。脳底動脈まで血管炎が進展すると、くも膜下出血を引き起こす。
●顔面麻痺と肥厚性硬膜炎は患者の聴力や生命を脅かす予後不良因子である。
→聴力と生命予後を守るために早期に肥厚性硬膜炎の診断が必要。
●肥厚性硬膜炎の予測因子は激しい頭痛である。
●OMAAVのANCAの種類に関して、日本や韓国などのアジア諸国ではMPO-ANCA陽性が多く、欧米ではPR3-ANCA陽性が多い。これはANCA関連血管炎に準ずる。
→顔面麻痺や肥厚性硬膜炎は地域に関係なく、共通して認める。
●本研究では37人(16%)がANCA陰性であったが、①現在の方法で検出出来ないANCA、②まだ発見されていない特異性のあるANCAがある、③ANCAが関与していないメカニズムなどが考えられる。
→より感度の高いキット(Wieslab®(Euro Diagnostica, Malmo, Sweden))を用いることで陰性だった患者のANCAが測定出来たとの事(データ未公表)。
●ANCAの陽性率は病変部位によって異なり、局所GPAの場合は陽性率60%、全身性GPAでは陽性率97%という報告あり(Auris Nasus Larynx. 2007;34:379–82.)。
●両ANCA陰性の患者では聴力障害と生命予後が不良であった。これは治療開始前までの期間が長かったことに起因すると考えられる。
→37人の両ANCA陰性患者の内、症状が耳だけの段階で組織学的証明されたり、ANCA関連血管炎の分類基準を満たしたのは11人(30%)だけで、70%が顔面麻痺や肥厚性硬膜炎、肺病変、腎病変が出現するまで診断がつかなかった。
●両ANCA陰性は肥厚性硬膜炎と関連があったことも予後と関連するかもしれない。
●両ANCA陰性患者の血清から検出されたBPI-ANCAとエラスターゼ-ANCAは化膿性肺疾患を伴う全身性血管炎(Intern Med. 2004;43:331–5.)、壊死性半月体形成性糸球体腎炎(Nephrol Dial Transplant. 2007;22:2068–71.)と関連している。
→これらの事実はMPO-ANCA、PR3-ANCA陰性の表現型が高い疾患活動性を表している可能性がある。
●PSLと免疫抑制薬の併用は長期寛解を達成し、聴力、生命予後を改善した。
●EULARの推奨でも臓器を脅かすANCA関連血管炎の寛解導入にはPSLとシクロホスファミドを併用すべきであると言われている(Ann Rheum Dis. 2009;68:310–17.)。特にANCA陽性の肥厚性硬膜炎では併用療法が必要である。
→OMAAVでも聴力や生命を脅かす可能性が判明しているため、初期より、免疫抑制薬併用療法を行うべきである。
Limitation
●第一に全国コホート調査であり、データの再現性を論じることが出来ない。
●第二に登録患者は日本国内の大学病院、紹介病院から選ばれた患者であるため、機関バイアスを考慮する必要がある。
●現在と過去の研究では、ほぼすべての患者が、耳鼻咽喉科診療所から大学・紹介病院に紹介され、難治性中耳炎の評価を受けた後、最終的にOMAAVと診断されている。
●したがって一次診療所で治療・経過観察を行い、本研究から脱落したOMAAV患者は相当数に上るはずである。
●第三に初診時から顔面神経麻痺、肥大性硬膜炎、肺・腎臓病変、再発までの期間をカウントしていないため、群間比較のための生存時間解析やCox比例ハザード回帰分析ができていない。
●最後に治療法の選択は主治医の裁量で決められていたため、治療法は一様ではなかった。
私からのComments
●OMAAVは局所のANCA関連血管炎と考える。
●高齢女性に多く、MPO-ANCA陽性が優位(60%)ですが、最終的な診断としてGPAが優位なのは実に興味深い。
●診断は難しい。耳鼻科から紹介されてもすぐ否定してはいけない理由を以下に示す。
①ANCAが陰性だから→過去の報告では『ANCA陰性が半数』
→4人の患者でANCA陰性から陽転化する、1回の陰性でも完全には否定できない!!
②病理が陰性だから→『病理でも血管炎所見は3分の1』
③他の臓器障害がないから→併存症の頻度は以下の通り決して高くない。
顔面麻痺(初診時22%、全経過36%)
肥厚性硬膜炎(初診時17%、全経過28%)
肺病変(35%)
腎病変(26%)
④ANCA関連血管炎の分類基準を満たさないから→『最初は耳だけのフェーズがあると考えた方が良い』
●併存症としては顔面麻痺、肥厚性硬膜炎は特に気を付けるべき!!
●顔面麻痺や肥厚性硬膜炎が出現するまで待っていたら、聴力障害と生命予後が不良となる(この二つは予後不良因子)。
→早期診断が求められます→問診と診察、Gd造影MRIが必須です!!
→激しい頭痛が肥厚性硬膜炎を示唆する症状ですが、乳突蜂巣炎でも激しい頭痛が起こり得るので、鑑別にはやはりGd造影MRIが必要。
●顔面麻痺、肥厚壊死はGPAに合併する事が報告されており、OMAAVもやはりGPAと関連すると考えるべきでしょうか…というか最終的にはGPAと分類されている症例が圧倒的!!
●14人(6%)が両側完全難聴、3人(1%)が疾患に関連して死亡しています。
→『耳だけだから』とステロイド中等量を単独で使用する医師も多いが、予後不良の経過となるため、重要臓器を脅かすANCA関連血管炎に準じて、初期治療から免疫抑制薬の併用を行うべき!!
●GPAに似ていると考えるのであればリツキシマブが有効かもしれません。
【参考文献】
Harabuchi Y, et al. Mod Rheumatol. 2017 Jan; 27 (1): 87-94. "Clinical features and treatment outcomes of otitis media with antineutrophil cytoplasmic antibody (ANCA)-associated vasculitis (OMAAV): A retrospective analysis of 235 patients from a nationwide survey in Japan."
ループス腎炎 EULAR/ERA-EDTA Recommendations 2019
ループス腎炎は全身性エリテマトーデス患者の40%に認める病態です。
2012年にEULAR/ERA-EDTAのループス腎炎ガイドラインが出ましたが、その後、カルシニューリン阻害薬の使用や、マルチターゲット療法、モニタリング、治療目標などについて新しいエビデンスが出てきたため、この度7年ぶりに改訂されました。以下にお示しします。
お忙しい方は包括的原則と、推奨の全体像だけご覧ください。
SLE EULAR recommendations 2019
●SLEについては上記の過去記事をご覧ください。
包括的原則

推奨の全体像




aPL: 抗リン脂質抗体, AZA: アザチオプリン, CNI: カルシニューリン阻害剤, CY: シクロホスファミド, ESKD: 末期腎不全, GFR: 糸球体濾過率, GoR: 推奨の格付け, HCQ: ヒドロキシクロロキン, ISN / RPS: 国際腎臓学会/腎病理学会, LOA: 合意のレベル, MMF: ミコフェノール酸モフェチル, MPA: ミコフェノール酸, RTX: リツキシマブ, SLE: 全身性エリテマトーデス, TAC: タクロリムス, UPCR: 尿タンパク質-クレアチン比
推奨の内訳
ループス腎炎が疑われる患者の検査

●"1.1"に示される蛋白尿や腎機能障害がある場合は腎生検を行う。
●軽度の臨床症状(例えば、ネフローゼに至らない蛋白尿)でも、活動的な組織学的病変と関連していることがある。
● 1970年から2016年の間に行われた腎生検のレビューでは、2001年から2016年の間に行われた尿の異常に基づく早期の生検は、同じ組織学的重症度であったとしても、転帰の改善と関連していた(Ann Rheum Dis 2018; 77: 1318–25.)。
●抗リン脂質抗体症候群性腎症(血栓性微小血管症)が予後に影響を及ぼす可能性があるため、推奨では書かれていないが、抗リン脂質抗体検査も実施すべきである。
●補体(C3/C4)とC1q、抗ds-DNA抗体も測定すべきである。
腎生検の病理学的評価

●2003年の国際腎臓病学会/腎病理学会(ISN/RPS)分類は現在でも腎生検の評価のゴールドスタンダードである。
●血栓性微小血管症(TMA)はループス腎炎の生検の最大25%で報告されているが、その予後は不明。
●間質の線維症や尿細管萎縮などの尿細管間質性病変は、予後不良と関連していた。
2003年国際腎臓病学会/腎病理学会(ISN/RPS)分類

※2018年の改訂(Kidney Int 2018; 93: 789–96.)で, IV型の分節性(IV-S), 全節性(IV-G)が削除された
免疫抑制療法の適応

●III型やIV型のループス腎炎では組織学的慢性度(chronicity)に寄らず、免疫抑制療法が推奨される。
●純V型ループス腎炎ではRAA系遮断薬を適切な期間(少なくとも3か月)使用したにも関わらず、1g/24時間以上の蛋白尿を認める患者では免疫抑制療法が推奨される。
●II型のループス腎炎は通常、特異的な免疫抑制療法を必要としないが、繰り返しの生検により、組織学的により侵襲性の高い病変に変化しやすい。
●蛋白尿が著しい場合は、見落とされていた増殖性変化を検出するために、組織学的な再評価(腎生検)を行うべきである。
成人のループス腎炎の治療
治療のゴール

●MAINTAIN試験、Euro-Lupus Nephritis Trailsの事後解析によると、12か月時点での蛋白尿は長期的な腎予後(末期腎不全のリスクや10年後の血清Cre値2倍化)を予測する最も優れた単一の予測因子であるため、12か月までに蛋白尿(蛋白Cre比)を0.5~0.7g/24時間尿未満になる事を目指す。●以前と比較して、治療開始から時間経過に応じて治療目標が設定された。
●しかしこの目標に達していなくても、50%までの患者も長期的に安定した腎機能を維持する可能性がある。
●全身性エリテマトーデスは全身疾患であるため、免疫抑制療法は腎外の症状の低疾患活動性、寛解もターゲットにすべきである。
初期治療

●コクランレビュー(Cochrane Database Syst Rev 2018;22:CD002922.)ではIII型、IV型ループス腎炎ではシクロホスファミドとミコフェノール酸モフェチル/ミコフェノール酸(MMF/MPA)の有効性は人種差はあれども同等とされている。
→アフリカアメリカ人ではMMFがより有効(Rheumatology 2010; 49: 128–40.)。
●10年間のEuro-Lupus Nephritis Trialでは低用量と高用量のシクロホスファミド(CY)の有効性は同等であり(Ann Rheum Dis 2016; 75: 526–31.)、低用量レジメンは欧州以外の地域で使用されている。このため、MMF/MPAと低用量CYの両方が寛解導入治療の第一選択肢として推奨される。
●MMFの推奨用量は2~3g/日(MPAでは1.44~2.16g/日)に変更となった。
●投与量は妊孕性、副作用、有効性、MPAのトラフ値に応じて適宜調整する。
●長期的なグルココルチコイドの副作用が明らかになったことに加えて、初期のmPSLパルス+低用量グルココルチコイド内服(<0.5mg/kg/日)が高用量と同等の効果がある事が判明してから、mPSL500-2500mgの範囲でパルスを行う事が推奨されるようになった(要領については疾患の重症度に応じて柔軟に決定する)。
●内服PSLは0.3~0.5mg/kg/日とし、3~6か月までに7.5mg/日以下に減量する。
●カルシニューリン阻害薬(CNI:タクロリムス(TAC)、シクロスポリン(CsA))の単剤またはMMF/MPAとの併用が注目されている。
●中国のRCTからTACとMMFを併用は短期的にはCYよりも優れていた報告がされた。
●第II相RCTでは、シクロスポリン類似物質であるボクロスポリンとMMFを併用した場合、MMF単独群と比較して6ヵ月後の完全奏効率が高かったが、前者の方が副作用や死亡例が多かった。
●多くのメタアナリシスでは、CNI(単独またはマルチターゲットレジメンの一部として)がループス腎炎において良好な有効性/毒性比を示す可能性が示唆されている。
→これらによって新しい声明(4.4)では、MMFとCNI(特にTAC)の併用は、特にネフローゼ症候群レベルの蛋白尿を有する症例において、治療の選択肢の一つとして含まれた。
●アジア以外の集団でのデータや、より長期の追跡調査や腎機能障害・腎不全の予防などの腎予後に関する研究が行われるまでは、CNIと『マルチターゲット』レジメンを第一選択の治療法として普遍的に推奨することはできない。
●さらに、CNIをベースとしたレジメンを選択する際には、CNI使用による腎毒性やその他の副作用を考慮する必要がある。
●純V型ループス腎炎では過去7年間に質の高いエビデンスは得られていない。
●MMF/MPAは第一選択としてIII型やIV型と同用量投与する事が推奨されている。
●CYとCNI(特にTAC)、特にCNIは単剤療法、またはMMFとの併用療法は別の選択肢となる。
●III型、IV型同様、リツキシマブ(RTX)はV型では上記の治療に反応しない患者の選択肢となるが、特発性膜性腎症を対象としたRCTではCsAに対する短期的な優位性が示されており、今後さらに優先順位が上がるかもしれない。
●ヒドロキシクロロキンは腎炎、慢性腎不全、死亡リスクの低下と関連する。
●米国眼科学会による改訂版の声明に従って、定期的な眼科スクリーニング(HCQの投与開始から5年後以降毎年、危険因子が存在する場合は開始から毎年)を無期限に継続すべきである。
→日本では開始から1年毎、リスク(腎機能・肝機能障害、累積投与量200g以上、視力障害を有する、高齢者)がある場合は半年毎。
●GFRが30mL/min未満の患者には、投与量の調整(50%減量)と発症から年1回の眼科診察が推奨される。
後療法

●MMF/MPAとアザチオプリン(AZA)は、初期段階で十分な反応が得られた場合、その後も使用し続けることが出来る。
●MMFの優位性を示したAspreva Lupus Management Study(ALMS)とは対照的にMAINTAIN試験(Ann Rheum Dis 2016; 75: 526–31.)の10年間の追跡調査では、この2つのレジメンは腎炎の再燃の点では有意差がなかった。
●MMF/MPAで寛解導入後にアザチオプリンを投与すると、再発が増加するという報告(N Engl J Med 2011; 365: 1886–95./Rheumatology 2013; 52: 480–6.)があるため、MMF/MPA投与後はそのままMMF/MPAを維持する事が勧められる。
●CY導入後はMMF/MPAとAZAのいずれも使用できる。妊娠を想定している場合や費用の点ではAZAを選択する。
●これらの薬剤は慢性的に使用すると、腎臓の副作用リスクが高まるため、CNIはV型のループス腎炎では最小有効量で使用する。
●ほとんどの腎炎の再燃は治療開始後、5~6年以内に発生する。それ以前に免疫抑制薬を中止しない事が推奨される。
●持続的な腎の寛解が達成出来たら、治療中断を考慮すべきだが、まず行うべきはグルココルチコイドの漸減である。免疫抑制薬はその後、漸減して行く。
●長期治療と長期の寛解持続期間は6年間の治療後に免疫抑制療法を中止した患者で腎炎再発リスクの低下と関連する。
●免疫抑制療法の期間は治療反応のタイミングと程度、無再発維持期間、腎外SLEの活動性、患者の希望に応じて個別化する必要がある。
無反応・難治性疾患

●標準治療で治療目標が達成できない場合は無反応または難治性疾患の可能性がある。
●治療を切り替える前に、尿蛋白の再検、アドヒアランスや薬物血中濃度測定を含めた評価が必要である。
●無反応症例ではMMF/MPA(2~3g/日)、CY、CNI(特にTAC)を含むすべての第一選択療法(単剤療法またはマルチターゲット療法)が推奨される。
●RTXのようなB細胞枯渇療法は、保険適応外ではあるが、単剤療法あるいはMMF/MPAやCYへの追加療法としても適応がある(循環中のB細胞を完全に枯渇させることで、76週での臨床的寛解が予測されている)。これはオビヌツズマブの試験で支持されている。
●RTXに反応した後、再発する事は珍しくはないが、一定の時間が経過した後に起こる。再発予防や治療のために反復投与が検討される。
●ベリムマブは、正式な適応症ではないが、RCTや観察研究の事後解析により、標準治療(MMFなど)に追加することで、蛋白尿や腎炎の再燃リスクを徐々に低下させる可能性が示唆されている。
●ループス腎炎に対するベリムマブ付加療法の有用性は第III相試験で報告された。
●最近、難治性疾患に対してRTXとベリムマブの併用療法が行われるようになってきている。
●感染症などの、グルココルチコイドや免疫抑制薬の増量の禁忌がある場合は高用量の免疫グロブリン静注(2g/kg)を検討できる。
●一方で血漿交換は適応にならない。
補助治療

●RAA系阻害薬は蛋白尿抑制作用、降圧作用があるため、妊娠していない患者では推奨される。
●腎機能低下の場合は慎重な使用と用量漸増が必要である。
●高血圧は130/80mmHg以下にコントロールすべきである。
●一般的な腎保護策(NSAIDsは回避するなど)は実践する。
●インフルエンザワクチンと肺炎球菌ワクチン接種は強く推奨される。
●帯状疱疹の生ワクチンも安全性が確認されている。
ループス腎炎のモニタリングと予後

●最初の6~12か月の蛋白尿と血清Cre値は血尿よりも長期予後においては感度が高い指標である。
●ほとんどの研究では蛋白尿の定量化は24時間尿と相関性が高いため、スポット尿での尿蛋白/Cre比で代用できる(尿蛋白が1000mg/24時間未満の場合は低くなる)。
●治療決定に先立って、24時間蓄尿による尿蛋白検査が望ましい。
●抗ds-DNA抗体の上昇は再発と関連しているが特異性は低めである。
●抗C1q抗体は急性ループス腎炎と高い関連性があり、再発も予測する可能性がある。
●腎生検を再検する事は免疫抑制療法が無効の場合に、活動性が持続しているか、不可逆的な腎障害が起こってしまっているかを区別するため、あるいは再発の場合に考慮される。
●ループス腎炎後の組織学的変化は40~76%に認められ、典型的にはV型からIII~IV型に変化する。
●免疫抑制療法後の腎生検再検では完全に寛解している患者でも30%に組織学的活動性が継続していることから、臨床的治療反応と組織学的な反応の間に不一致が生じることが多い事が分かる。
●組織学的活動性の持続は、免疫抑制療法を減量して行った場合に、腎炎の再燃を強く予測する。
ループス腎炎における末期腎不全の管理

●最近の研究ではループス腎炎における末期腎不全のリスクは15年間で10%未満まで低下している。しかし、患者の中には不可逆的な腎障害に進行し、罹患率や死亡率のリスクを高める患者もいる。
●腎代替療法を受けた後は通常、病状は沈静化し、再燃(腎性、腎外性)の発生頻度は低くなるが、それでも発生する可能性はある。
●腎代替療法の中でも血液透析と持続的腹膜透析は、後ろ向き比較研究では同程度の患者生存率を示す。
●対照的に腎移植は10年生存率が高い。米国のデータによると、腎移植を受けたループス腎炎性末期腎不全患者は受けていない患者と比較して死亡率が70%減少する。
●先制移植を受けている患者はごく一部だが、その10年生存率は94%であり、腹膜透析の76%、血液透析の42%と比較して高いため、移植が他の腎代替療法よりも優先される場合がある。
●移植は遅らせるべきでなく、血清学的な活動性のみがある場合でも安全に行う事が出来る。
●移植された腎臓でループス腎炎が再発する事は臨床的にほとんどない。
●移植されたループス腎炎患者は免疫抑制薬の影響で日和見感染のリスクが高まる
抗リン脂質抗体症候群とループス腎炎

●抗リン脂質抗体症候群関連腎症は稀であるが、抗リン脂質抗体によって誘発される血管性腎症の異なるタイプである。
●血栓性微小血管症(TMA)が抗リン脂質抗体症候群関連腎症の特徴として考えられているが、TTP/HUS、悪性高血圧症、補体介在性TMAなどでも類似病態があるため、TMAは病因ではない。
●抗リン脂質抗体症候群の治療指針となる対照研究はない。
●HCQに加えて、抗血小板薬や抗凝固薬が推奨される。
●RAA系阻害薬は疾患の進行を遅らせる可能性がある。
ループス腎炎と妊娠

●UPCRはRAA系阻害薬(妊娠第一期に催奇形性を起こすため禁忌薬)を用いずに500mg/g未満にコントロールする事が理想的である。
●グルココルチコイド、AZA、CNI、HCQは使用可能だが、妊娠中も授乳中も安全な用量で継続しなければならない。
●妊娠を予定よりも6か月前にMMFを中止する事で、代替薬の忍容性と有効性を評価する事が出来る。
●妊娠中に安全性のある治療に反応しない重篤な再燃が起こった場合はリスクとベネフィットのバランスを考慮した上で、妊娠の中止や胚毒性のある薬剤の使用を検討する事もある。
小児ループス腎炎の管理

●小児のSLEは成人のSLEと比べて腎病変を呈する事が多く、腎炎が50%以上の患者で見られる。
●2012年のEULAR/ERA-EDTAの勧告以降、小児SLEとループス腎炎の専門家で構成される欧米のグループが小児発症ループス腎炎の管理に関する勧告を発表しているが、どちらも成人の研究データに基づいている。
●診断、治療、モニタリングは成人のループス腎炎の指針に従う。
小児の投薬量

IV: Intravenous; MP: メチルプレドニゾロン; BSA: Body surface area; CKD: 慢性腎臓病
これからの研究課題
診断
●様々な民族における臨床症状、組織病理学的特徴、治療への反応、予後因子、遺伝的背景(例:APOL1)
●国際腎臓学会/腎臓病理学会の分類基準の改訂(進行中)
●非定型ループス腎炎:ポドサイトパチーとpauci-immune lupus nephritis、その他
●非ループス(または抗核抗体陰性)糸球体腎炎へのアプローチ
●腎炎再発の定義
既存の治療法と疾患モニタリング
●アジア人以外の患者におけるカルシニューリン阻害薬の有効性
●ループス腎炎におけるB細胞標的療法(例:ベリムマブ、リツキシマブとベリムマブの組み合わせ、オビヌツズマブ)、サイトカイン阻害薬
●腎線維症のイメージング
●治療期間と中止
●長期で発生する臓器ダメージ
●定期的な腎生検の再検:早期 vs 後期、再検の意義
●高血圧、肥満、脂質異常症などのループス腎炎の進行における非免疫メカニズム
●患者教育プログラムの影響
●抗リン脂質抗体症候群関連腎症におけるエクリズマブの役割
病態生理とバイオマーカー
●分子Signatureまたは他のバイオマーカーに基づくサブグループのリスク層別化
●ループス腎炎の種類と活動状態(尿細胞、Omicsなど)を分類するための非侵襲的方法
●腎前駆細胞及びループス腎炎におけるそれらの増殖
●ループス腎炎の腎臓修復
●Liquid biopsyのためのバイオマーカー
試験のデザイン
●分子Signatureまたはバイオマーカーに基づくサブグループのリスク層別化
●革新的なトライアルデザイン
●『標準治療』の最適化
●臨床試験のエンドポイントの良い定義
【参考文献】
Fanouriakis A, et al. Ann Rheum Dis. 2020 Mar 27. pii: annrheumdis-2020-216924. "2019 Update of the Joint European League Against Rheumatism and European Renal Association-European Dialysis and Transplant Association (EULAR/ERA-EDTA) recommendations for the management of lupus nephritis."
全身性アミロイドーシスに対する腹壁脂肪吸引生検の方法
アミロイドーシスに対する腹壁脂肪吸引生検の感度は消化管生検よりも高いといわれます。加えて安全かつ簡便であるため、一般内科医でも実施する事が可能です。
インターネットをサーフィンしていると、『アミロイドーシス診療支援サービス』というサイトにたどり着きました。熊本大学脳神経内科の先生が筆頭に開設して下さっているようです。
ここでは以下のように腹壁脂肪吸引生検の方法を教えてくれています。
すごく簡単なので、アミロイドーシス疑いの患者様がいらっしゃったら、是非実践してみてください!!
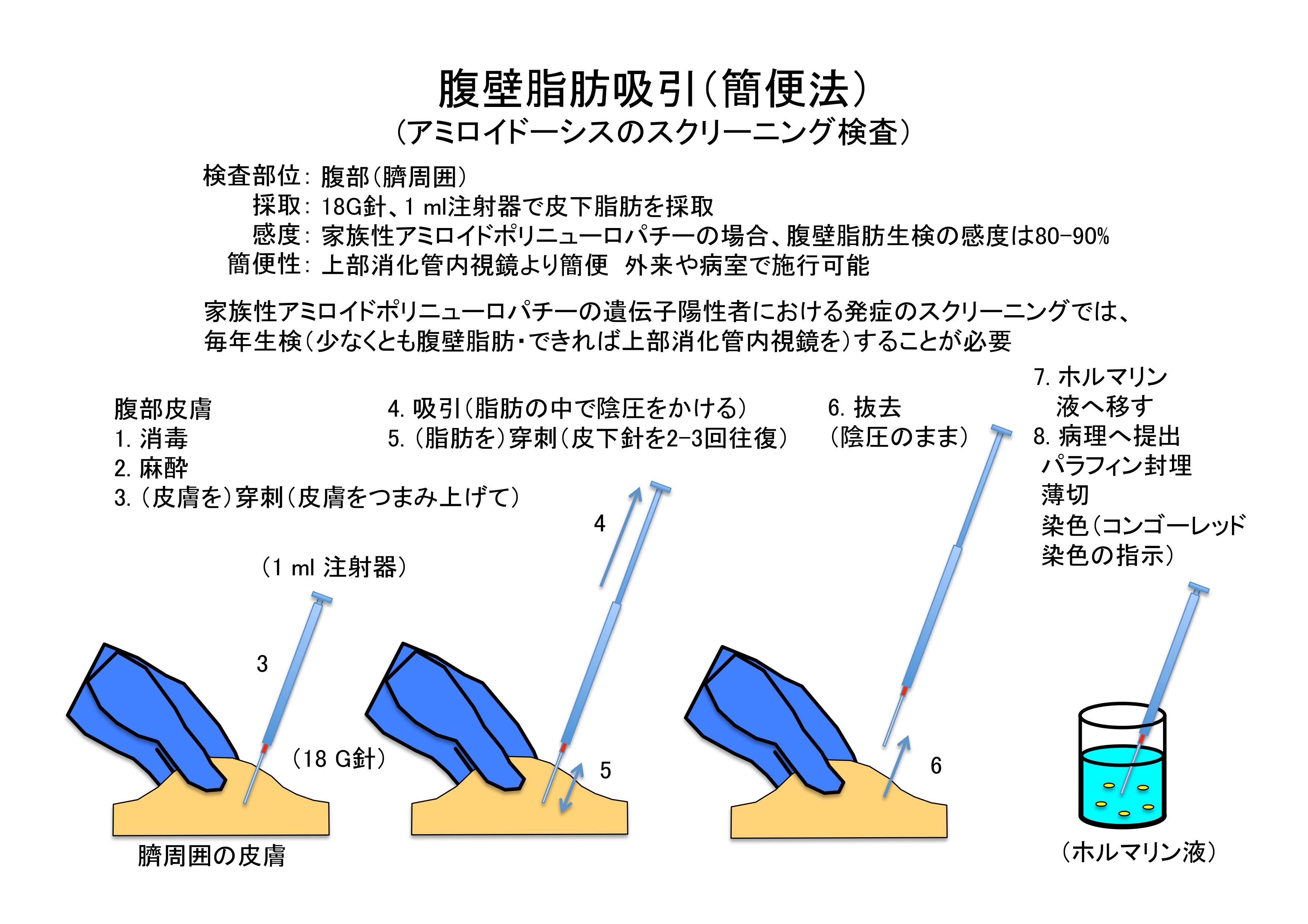
なお、同サイトで全身性アミロイドーシスの特徴についてもまとめてあります。
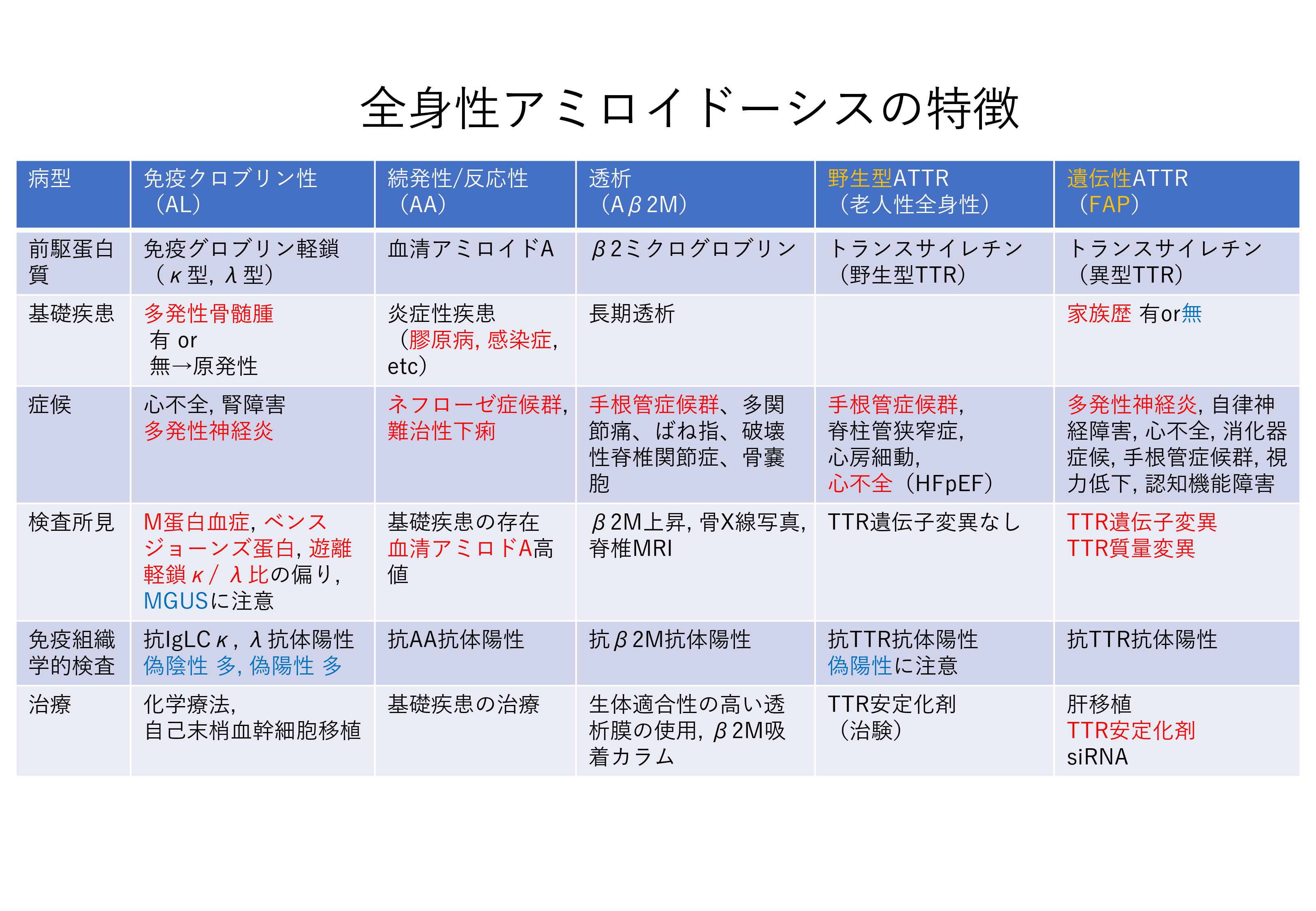
【参考文献】
『アミロイドーシス診療支援サービス』