稀だが忘れてはならない脅威~リウマチ性血管炎~
滑膜炎が主体である関節リウマチに血管炎が生じた場合にリウマチ性血管炎と呼びます。日本では予後の悪さのため、悪性関節リウマチと言われており、難病の指定にもなっております。
最近、入院患者でリウマチ性血管炎が疑われる患者を担当したので、まとめました。
【ポイント】
・長期コントロール不良の重症関節リウマチの合併症の一つにリウマチ性血管炎がある
・日本の悪性関節リウマチは欧米で提唱されているリウマチ性血管炎とはやや異なる病態も含む(難治性や重症の関節リウマチ)
・関節リウマチの治療戦略の向上とともに、リウマチ性血管炎の頻度は下がってきているが、死亡率は相変わらず高いままであるため、早期の認知と治療が必要
・病態は小血管や中血管の血管炎
・罹患臓器は皮膚、神経、心血管、眼が多いが、腎、肺、消化管、中枢神経などは稀
・血管炎の重症度や罹患臓器によって治療を選択する
・グルココルチコイドが第一選択だが、軽症であれば中等量、重症であれば高用量
・その他、重症であればシクロホスファミド、リツキシマブ、血漿交換など
・ヒドロキシクロロキンと低用量アスピリンは予防に有用
・喫煙は唯一の環境因子であるため、禁煙は必須
【概要】
・1898年にBannatyneによって初めて報告され、1984年にScottとBaconによって定義された
・日本では悪性関節リウマチと呼ばれているが、欧米ではリウマチ性血管炎と呼ばれる
→日本の悪性関節リウマチには難治性や重症例の関節リウマチが含まれてしまっているため、厳密に言えば、海外で提唱されているリウマチ性血管炎とは同一の病態を示している訳ではない
・長期、重症、Seropositive(RF、抗CCP抗体が陽性)、コントロール不良の関節リウマチの合併症の一つ
・小血管や中血管に壊死性または白血球破砕性血管炎を起こす
・様々な生物学的製剤が登場し、関節リウマチがコントロールできるようになってから、リウマチ性血管炎は稀になってきた
・しかし、一度罹患すると、経済学的にも、生命予後的にも不良であるため、早期の認知と治療が必要
【病因】
抗内皮細胞抗体
・抗内皮細胞抗体が関節リウマチ患者では15~20%発現するのに対してリウマチ性血管炎患者では約75%に見られる
・これらの抗体は抗体依存性細胞傷害性(ADCC)と抗体依存性補体媒介性細胞傷害性(CDC)に関与する可能性がある
免疫複合体の沈着と補体の活性化
・循環免疫複合体は全ての患者で認められ、リウマチ性血管炎のマーカとなり得る
・特にIgA型免疫複合体は感度が低いが特異的
・IgG型やIgM型免疫複合体は古典的補体経路を介して補体を活性化させるが、IgA型は代替経路を活性化させる
・IgA型免疫複合体はIgG型免疫複合体のように赤血球への結合能がないため、肝臓や脾臓でトラップされず、それら以外の臓器に沈着し、血管炎を起こす可能性がある
・また活動性の関節リウマチ患者とリウマチ性血管炎患者の単球は寛解期の関節リウマチ患者の単球と比べるとIgG型免疫複合体への結合と分解能力が落ちている
・これは補体受容体の発現低下と活性化されたC3bを分解する能力の低下による
・さらにリウマチ性血管炎患者で見られるC1q抗体は免疫複合体の正常な補体オプソニン効果を阻害する
TNFα
・TNFαや他のサイトカインレベルが上昇すると内皮細胞が白血球接着分子を発現し、循環白血球が結合して活性化しやすくなる
・TNFα自体が血管透過性を亢進させ、一酸化窒素シンターゼ活性の起こす活性化内皮細胞フェノタイプを誘導する
・TNF活性化内皮細胞によって産生された一酸化窒素は活性酸素と相互作用して内皮細胞を傷害する
細胞接着分子
・ICAM-1、E-セレクチン、TNFαの著明な発現が活動性リウマチ性血管炎に多く見られるが血管炎を伴わない関節リウマチでは見られない
細胞性免疫
・健常者では見られないCD4+CD28欠損 T細胞が血管障害に関係する
・この細胞は細胞傷害性Tリンパ球やNK細胞と同じ機能を持ち、大量のインターフェロンγを放出する、また細胞溶解性顆粒を放出する
・血管炎以外にも関節外症状を持つ患者ではCD4+CD28欠損 T細胞が炎症部位で高頻度で見られる
・グランザイムBを発現しCD25(IL-2受容体)・PD1陰性のCD8陽性T細胞もCD4陽性T細胞よりも血管壁に浸潤している
遺伝子
・遺伝子的解析ではHLA-DRB1、HLA-C*03、KIR2DS2遺伝子が発症に関連している
・HLA-DRB1(*0401/*0401, *0401/*0404, *0101/*0401)がリウマチ性血管炎と関連している
・HLA-DRB1*04を持っていない患者ではHLA-C3が関与する
・KIR2DS2(killer cell immunoglobulin-like receptor)遺伝子がリウマチ性血管炎で健常者、血管炎のない関節リウマチ患者と比べて多くみられる
・HLA-C ligandと共に、この遺伝子はCD4+CD28欠損T細胞による血管障害に重要な役を担っている
環境因子
・喫煙が最も発症に関連する
・喫煙はB細胞やT細胞を介して動脈内膜の障害、内皮細胞の機能不全、細胞成長を調整するp53遺伝子を変異させる可能性がある
その他
・グルココルチコイドとウイルス感染がトリガーとして考えられているが、根拠は薄い
【疫学】
・NORVASCのデータより、罹患率は1988~2000年では9.1人/100万であったが、2001-2010年では3.9人/100万と低下傾向である
・別の報告より、1985~1994年のコホートと比較して1995~2007年のコホートでは他の関節外症状は減少していないが、リウマチ性血管炎だけが低下している(3.6% vs 0.6%)
・日本では平成28年度の指定難病受給者証を持っている患者は6067名で関節リウマチ患者の0.6%→ただし、この難病申請のための診断基準は緩く、結構な確率で難病登録できてしまうため、正しい数であるとは限らない
・近年リウマチ性血管炎が減少傾向であるが、これは関節リウマチの治療が強化されたこと、禁煙が進んだことによる
・リウマチ性血管炎の発症年齢の中央値は63歳
・リウマチ性血管炎を起こす関節リウマチの平均罹患期間は10.8~15.6年
・男性、関節外症状、強力な治療が必要な重症関節リウマチに多い→日本では女性
・Mayo Clinicの報告ではリウマチ性血管炎患者の1/3が喫煙者、1/3に関節外症状あり
・関節リウマチ発症から5年以内にリウマチ性血管炎を起こした報告があるが、この場合は予後は不良
【リスク】
・男性→日本では男女比は1:2と女性に多い
・関節リウマチの長期罹患歴
・診断時の喫煙の習慣(OR1.98)
・末梢血管疾患の併存(OR3.98)
・脳血管疾患の併存(OR6.48)
・重症患者(リウマチ結節、関節手術の既往、X線で骨びらんあり)(OR2.02)
・生物学的製剤の使用(OR2.80)→これは単に重症関節リウマチだからなのかもしれない
【臨床症状】
・全臓器の小血管炎、中血管炎が主体
・全身症状として発熱、体重減少など
・障害臓器として皮膚、末梢神経が最多、次いで心血管、眼
・腎、肺、消化器、中枢神経病変は稀だが致死的
・結節性多発動脈炎と似て多発単神経炎、紫斑、消化器血管炎を起こすが、微小動脈瘤は起こさない
・関節外症状、皮膚症状としてリウマチ結節を認める(30-44%)
・関節炎が燃え尽きた後に起こると言われるため、関節腫脹や圧痛がないことが多い
→日本の様々な大学、難病情報センターのホームページでは『関節炎があるところに加えて』と、関節炎の併存を悪性関節リウマチの条件としていますが、どちらが正しいのでしょうか…
・関節炎が燃え尽きた患者では併存症(心血管、末梢神経疾患)や関節外合併症が多い(Felty症候群、肺線維症)
・Felty症候群を呈する患者ではリウマチ性血管炎を起こす傾向にある
・最近の報告では治療成績の向上のため、リウマチ結節とFelty症候群の罹患率が減少
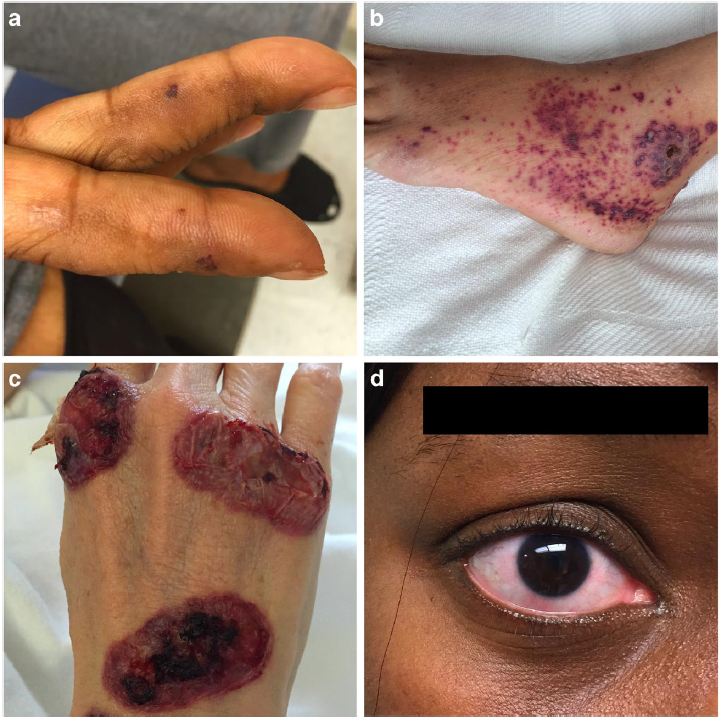
a:手指梗塞, b:下腿の紫斑, c:手背の壊疽性膿皮症, d:強膜炎
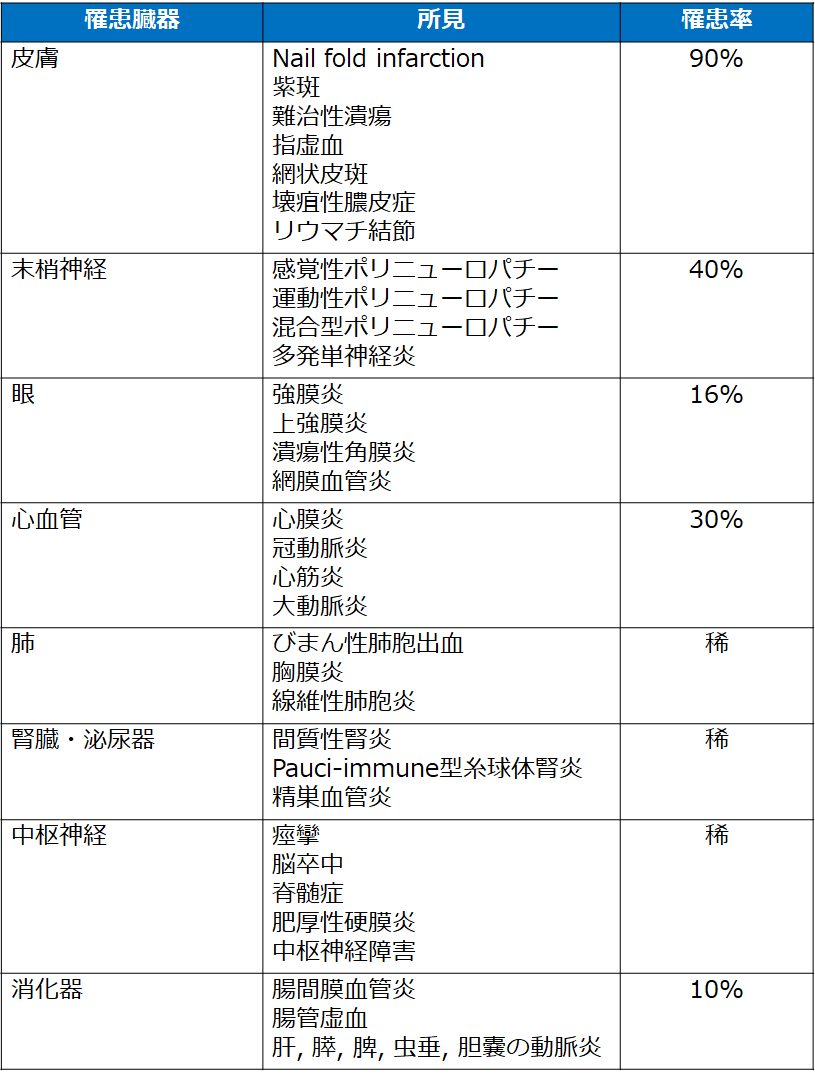
皮膚病変(90%)
・全身の症状がないnail fold inferctionが最も多い
・その他、難治性下腿潰瘍、触知可能な紫斑、壊疽性膿皮症、下肢優位の趾虚血など
・下腿潰瘍は動脈硬化性病変と異なり、足背、足関節近位(内果、外果)に起こる
→中型動脈の壊死性血管炎の結果
・リウマチ結節は他の皮膚症状と独立して存在する
末梢神経病変(40%)
・末梢の感覚・運動神経障害
・重症の多発単神経障害が多い(非対称性、非同期性、遠位神経優位)
・血管炎性ニューロパチーは急速に進行する
・血管炎性ニューロパチーの回復は非常に遅く、通常12~18か月かかる
・血管炎性ニューロパチーは原則として痛みは顕著ではない
眼病変(16%)
・強膜炎が最多だが、最も重症なのは潰瘍性角膜炎。いずれも眼痛が特徴的
・両側性強膜炎も稀ではない
・強膜炎はびまん性、結節性、壊死性に分けられるが、それぞれが移行することはない
・壊死性は最も重篤で血管炎と高度に関連し、強膜軟化症になる可能性がある
・壊死性強膜炎はしばしば潰瘍性角膜炎と共存する、いずれも緊急疾患
・孤発性の上強膜炎は一般的に予後良好だが、強膜炎を伴う場合がある
心血管(30%)
・冠動脈炎と大動脈炎も起こし得る(NORVASCとMayo Clinicのデータでは冠動脈炎は認めなかったが)
・心膜炎も見られる
肺病変(稀)
・びまん性肺胞出血はANCA関連血管炎やGoodpasture症候群に似る
・間質性肺炎は関節リウマチでも比較的見られるため、血管炎によるものと区別が必要
・リウマチ結節が肺にできることもある
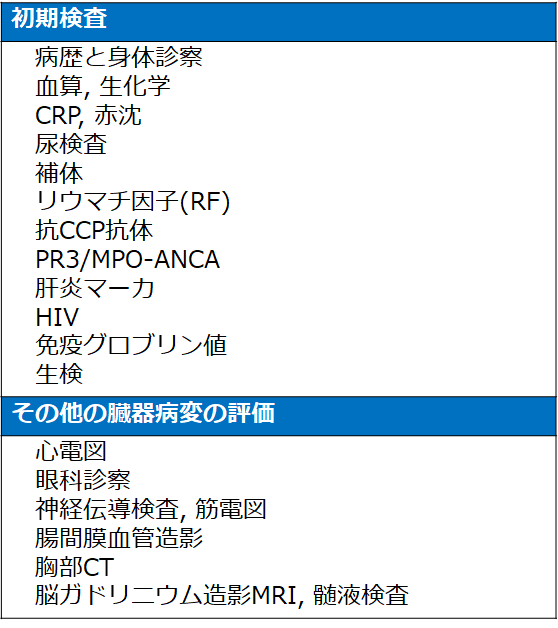
【検査】
・しばしば炎症マーカ(CRP、ESR)が上昇する
・RFと抗CCP抗体は関節リウマチよりも高値となるが、リウマチ性血管炎の独立したリスクファクターではない
・RFと抗CCP抗体異常高値がなければ90%の確率でリウマチ性血管炎ではない
・RFのうち、IgG型はリウマチ性血管炎の疾患活動性に関与するが、通常のIgM型は疾患活動性に関与しない
・免疫複合体は全ての患者で見られる
・IgA免疫複合体は感度が低いが特異的(研究室レベルでの検査となる)
・抗核抗体が非特異的に見られることもあるが、関節外疾患や関節リウマチの合併症に関連して見られ、死亡率の予測因子となり得る
・その他、血小板増加、貧血、低アルブミン血症
・低補体血症とクリオグロブリン血症が認められるが、これらは関節リウマチ患者では診られない
・C4低下は予後不良マーカ
・p-ANCA(核周囲)が36-48%に見られるが、MPO/PR3は陰性
→おそらくは他の核周囲のANCA抗原(ラクトフェリン、エラスターゼ、カテプシンGなど)に反応していると思われる
・確定診断には血管炎の証明が必要(皮膚・神経・筋肉生検)、口唇生検も有用かも
・組織学的には全ての血管層に好中球、リンパ球、形質細胞が浸潤し、血管壁が破壊されている
・SLEでは後毛細血管細静脈が典型的には障害される
・神経伝導検査で末梢神経障害を証明する
・消化器病変がある場合は結節性多発動脈炎の微小動脈瘤の有無を確認するために腸間膜血管造影が必要
【組織】
・単球、好中球の血管壁への浸潤、血管壁の破壊(壊死、白血球破砕、弾性繊維の破壊)
・血管壁の3層以上障害が感度、特異度ともに高い
・関節リウマチでも限局型毛細血管炎、血管壁への細胞浸潤を伴わない血管周囲の細胞浸潤を認めるk十があるが、これらを間違えてリウマチ性血管炎と診断しない
・結節性多発動脈炎で見られる微小動脈瘤は見られない
ちなみに指定難病の診断基準は以下の通りです

ACR/EULAR による関節リウマチ分類基準2010年を満たし、上記に掲げる項目の中で
(1)Aの臨床症状・検査所見の内、3つ以上を満たすものまたは
(2)Aの臨床症状・検査所見の内、1つ以上とBの組織所見を満たすものを
悪性関節リウマチと診断しています。
こちらもご覧ください
【鑑別診断】
・点状出血や紫斑は他の血管炎と区別する所見にならない
・下腿潰瘍の分布と治療への反応性、生検が動脈硬化性潰瘍との区別になる
・TNF阻害薬やトシリズマブの使用がリウマチ性血管炎のリスクとなるため、薬剤性血管炎も鑑別に考慮する
・その他、HBV関連血管炎、HCV関連クリオグロブリン血症、ANCA関連血管炎
・難病申請の際の除外疾患としては感染症、続発性アミロイドーシス、治療薬剤(薬剤誘発性間質性肺炎、薬剤誘発性血管炎など)の副作用、が挙げられる
・またその他の膠原病(全身性エリテマトーデス、強皮症、多発性筋炎、シェーグレン症候群)との重複症候群、痛風、乾癬性関節炎にも留意する
・リウマチ性血管炎に10%合併するというFelty症候群にも注意する
ちなみに一般的な血管炎のミミックはこちら
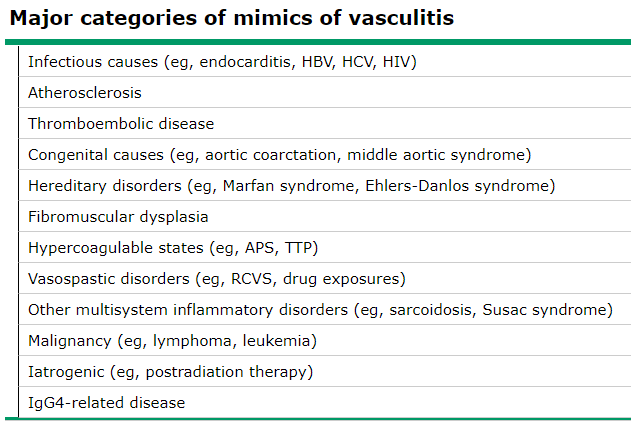 RCVS: reversible cerebral vasocnstriction syndrome
RCVS: reversible cerebral vasocnstriction syndrome
【治療】
・血管炎の重症度と障害臓器に応じた治療をする
《寛解導入》
全身性のリウマチ性血管炎の特徴がない皮膚潰瘍患者
・創傷ケアと局所感染予防
・静脈うっ滞があれば解除する
①潰瘍径が1㎝未満で徐々に進行する場合
・プレドニン0.5~1.0mg/kg/日を重症度に合わせて経口投与
②潰瘍径が1㎝を超える場合
・7日間注意深く観察し、急速に進行しない場合はプレドニン1mg/kg/日経口投与
③急速に進行する直径2-3㎝を超える複数の潰瘍
・経静脈的コルチコステロイドの投与(パルス3日後、後療法を行う)
TNFα阻害薬使用中の皮膚血管炎
・TNFα阻害薬に関連した血管炎である場合は、通常中止で改善する(2-4週間経過観察)
・全身性壊死性血管炎はTNFα阻害薬関連血管炎では稀
・潰瘍病変悪化傾向であれば上記に準じて治療する
全身性リウマチ性血管炎の場合
・難治性皮膚潰瘍、深部潰瘍、深部潰瘍を伴わない難治性蕁麻疹様血管炎などの他の重症皮膚病変、重度の強膜炎、血管炎性ニューロパチー、重症指趾虚血、腎・肺疾患、心膜炎などの内臓病変を含む
・高用量コルチコステロイド(パルス後、高用量ステロイド)+リツキシマブが推奨される
・リツキシマブが使用できない場合はIVCYを選択する
・妊孕性の観点からはリツキシマブ、血漿交換を行う場合はリツキシマブの有効性が下がる可能性があり、シクロホスファミドを選択する
・メトトレキサートを既に内服している患者でリツキシマブを使用する場合はメトトレキサートは継続することが推奨される
・メトトレキサートを既に内服している患者でシクロホスファミドを使用する場合はメトトレキサートは免疫抑制の観点から中止することが推奨される(レフルノミドも)
・TNFα阻害薬、他の生物学的製剤、JAK阻害薬などはリツキシマブまたはシクロホスファミド使用中は中止する
・リツキシマブまたはシクロホスファミドの初期治療に不応な場合、グルココルチコイドの量を増やし(高用量経口またはパルス)、リツキシマブ→シクロホスファミド、またはシクロホスファミド→リツキシマブへと切り替える(リツキシマブ→シクロホスファミドの場合はリツキシマブ4回投与後に切り替え、シクロホスファミド→リツキシマブの場合、6-8週間の初期治療に反応がない場合はリツキシマブに変更)
・血漿交換も選択肢のひとつ
・リツキシマブとシクロホスファミドが使用できない場合や不応の場合、アザチオプリンやミコフェノール酸モフェチル(1000~1500mgを1日2回)を使用する
・治療2か月間で20mgまで下げ、その後4~8か月で5mg/日以下にする
・20mgまでは毎週5mgずつ下げる、その後は1mgずつ
リツキシマブ
・375mg/m2を毎週投与を計4回または2週間感覚で2回1000mgを投与する
・効果は同等
・リツキシマブが有効であった報告(Arthitis Care Res. 2012;64(3):331-9.)
・抗CCP抗体、免疫複合体が異常高値の場合はリツキシマブ(B細胞減少療法)が有効かもしれない
シクロホスファミド
・2週間毎に15mg/kg(最大1200mg)を3回、その後3週毎に15mg/kg(最大1200mg)
・寛解に達するとさらに3か月追加する
・ANCA関連血管炎での寛解は通常6-7回の投与で得られる
・経口シクロホスファミド最大2mg/kg/日も有用だが、ステロイドパルスを併用することが必要
アザチオプリン
・2mg/kg/日で開始する(最大用量は成人で2.5mg/kg/日 or 250mg/日を超えない量)
・開始前にチオプリンメチルトランスフェラーゼ(TPMT)対立遺伝子の存在を調べる
・Mayo Clinicの報告ではほぼ全例で高用量コルチコステロイド、29%がシクロホスファミドを使用している、その他55%がアザチオプリン、メトトレキサート、ミコフェノール酸モフェチル、TNFα阻害薬、リツキシマブ、アバタセプト、アナキンラなど
《寛解維持》
リツキシマブで導入後
・6か月ごとに2週間で2回リツキシマブ500mgを投与する
・メトトレキサートを継続することが望ましい(25mg/週+葉酸1~3mg)が、難しい場合、リツキシマブ療法開始から4~6週間以内にアザチオプリンを使用する、通常2mg/kg/日経口投与
・6-12か月後に再発がない場合は慎重に減量する
シクロホスファミドで導入後
・アザチオプリンで寛解維持を行う(通常2mg/kg/日経口投与)
・6-12か月後に再発がない場合は慎重に減量する
・代替薬はメトトレキサートまたはミコフェノール酸モフェチル
・導入後3か月以内に血管炎が寛解に達した場合、シクロホスファミドによる治療3か月後に維持療法に切り替える
・3か月で寛解導入に至らない場合でも導入療法を6か月以上継続することは避ける
・維持療法は好中球数1000/μL以上になるまで保留する
・リツキシマブで維持を行う場合、シクロホスファミド導入後3か月経過した時点で2週間で500mgを2回、その後6か月、12か月、18か月に1回投与する
・リツキシマブは炎症性関節炎に関してはMTXやアザチオプリンよりも有効
・疾患活動性を示唆する症状や所見がなく、炎症マーカが正常化した患者では約9か月で維持療法を中止し、少なくとも月1回のフォローを6~12か月行う
その他
・喫煙者ならば禁煙を勧める
・血圧のコントロール、皮膚潰瘍の局所治療も重要
・ヒドロキシクロロキンと低用量アスピリン(81mg)が予防に有効(3)
あるReviewが提唱するマネジメント案をお示しします(2)
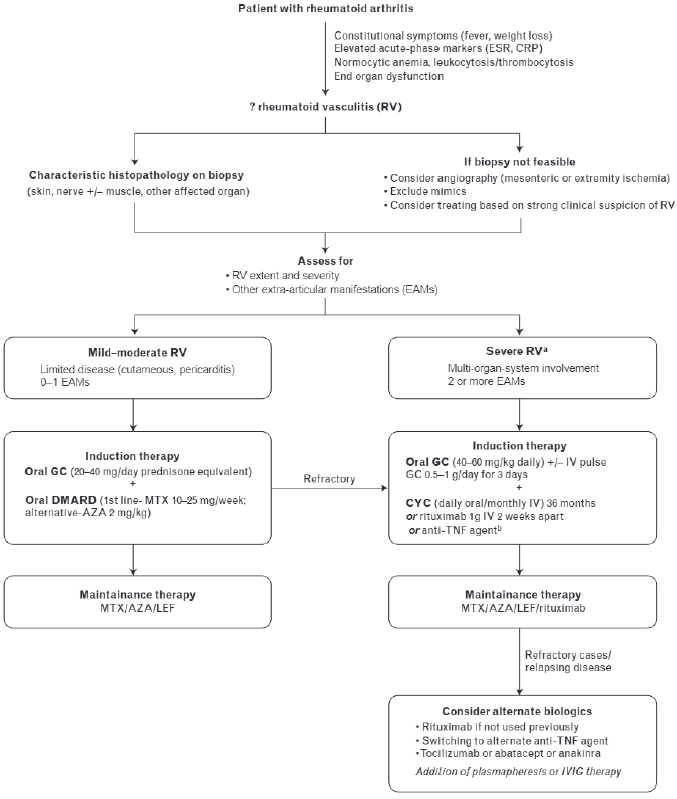
【予後】
・死亡率は26-30%(1年死亡率は12%、5年死亡率は60%という報告もある)
・死因は臓器障害と感染症
・リウマチ結節や孤発性爪郭梗塞は全身性リウマチ性血管炎への進展リスクが少ないため、予後良好
・関節リウマチの治療が強化されているが、リウマチ性血管炎の死亡率は以前と変わらない
・難病情報センターより、軽快21%、不変26%、悪化31%、脂肪14%、不明・その他8%という報告あり
【参考文献】
(1) Kishore S, et al. Curr Rheumatol Rep. 2017 Jul;19(7):39. Rheumatoid Vasculitis: A Diminishing Yet Devastating Menace.
(2) Makol A, et al. Curr Opin Rheumatol. 2015 Jan;27(1):63-70. Rheumatoid vasculitis: an update.
(3) Makol A, et al. Rheumatology (Oxford). 2014 May;53(5):890-9. Vasculitis associated with rheumatoid arthritis: a case-control study.
(4) 難病情報センターホームページ『悪性関節リウマチ』
(5) UpToDate『Etiology and pathogenesis of rheumatoid vasculitis』Last Update:Jun 01, 2018.
(6) UpToDate『Clinical manifestations and diagnosis of rheumatoid vasculitis』Last Update:Feb 07, 2019.
(7) UpToDate『Treatment of rheumatoid vasculitis』Last Update:Feb 12, 2019.