EGPA(好酸球性多発血管炎性肉芽腫症)③~疫学と症状と鑑別~
今回は好酸球性多発血管炎性肉芽腫症(EGPA)の疫学と症状、鑑別についてまとめます。
分類基準についてはごちら。
病因・組織病理についてはこちら。
治療と予後についてはこちら。
【ポイント】
・発症年齢の中央値は49-59歳
・ほぼすべての患者で気管支喘息の既往があり(>90%)
・喘息の発症からEGPAの診断までの期間の中央値は5-9年
・好酸球数は著明に上昇(中央値約8000/μl)
・ANCAはEGPA患者の30-47%で陽性となるが通常はMPO-ANCA
・臓器病変として最も多いのは末梢神経と副鼻腔(それぞれ51-98%, 48-96%)
・ANCA陽性EGPAでは糸球体腎炎、肺胞出血および末梢神経障害が多い
・ANCA陰性EGPAでは心病変が多い
・ANCAの有無で臨床症状が変わるが、実は遺伝的背景が異なる事が分かってきた
・好酸球性障害では寄生虫感染、薬剤アレルギー、ホジキンリンパ腫などの血液悪性腫瘍などを除外する必要がある
・傷害臓器が肺に限局している場合、好酸球性肺炎とアレルギー性気管支肺真菌症を考慮する。いずれも喘息患者でしばしば発症し、移動性浸潤影を呈する
・好酸球増多症を伴い、肺外臓器障害が出現している場合、特発性好酸球増加症候群(HES)、IgG4関連疾患が重要な鑑別となる
【疫学と症状】
・いくつかのコホート研究が報告されており、以下にまとめる
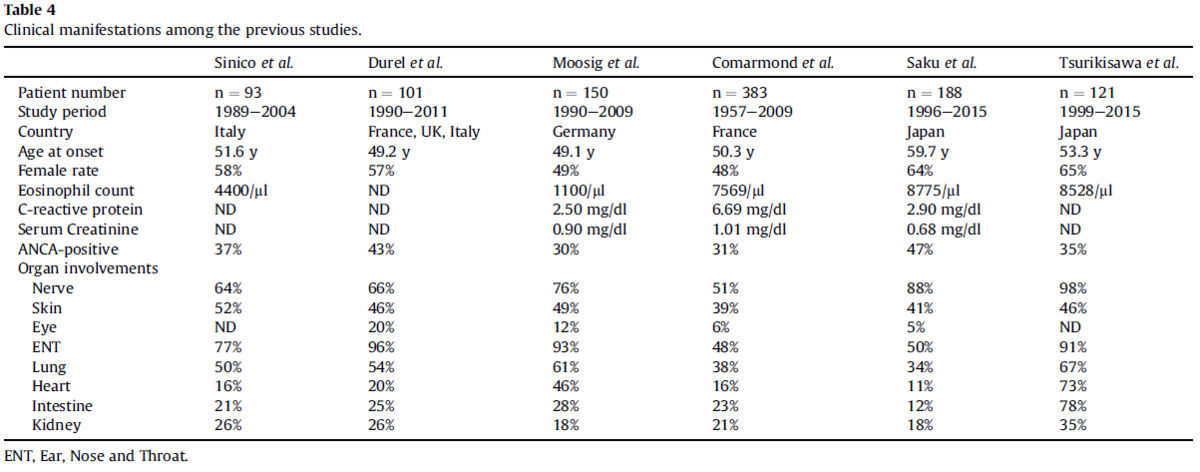
・発症年齢の中央値は49-59歳
・極端に性別に差はなく、女性の割合は48-64%
・ほぼすべての患者で気管支喘息の既往があり(>90%)
・喘息の発症からEGPAの診断までの期間の中央値は5-9年
・ ほとんどの研究で好酸球数はACRまたはLanham基準に従って著明に上昇していた(中央値約8000/μl)だが、ドイツのグループの報告では好酸球数は軽度上昇に留まった(中央値1100/μl)
・CRPの中央値は2.5-6.6mg/dl
・血清Cre値は著明な上昇はなし(中央値0.68-1.01mg/dl)→これは他のANCA関連血管炎とは異なる
・ANCAはEGPA患者の30-47%で陽性となるが通常はMPO-ANCA
・臓器病変として最も多いのは末梢神経と副鼻腔(それぞれ51-98%, 48-96%)
・末梢神経障害は典型的には多発単ニューロパチーだが、時に遠位対称性多発神経障害(24%)、非対称性多発ニューロパチー(10%)、腰部神経根症(3%)が見られることもある
・肺病変も頻繁に見られ(約40-60%)、好酸球性肺炎に似て末梢優位の移動性の斑状浸潤影を呈する
・肺結節、肉芽腫性腫瘤病変、肺胞出血は比較的稀
・心病変と胃腸病変は頻度が高いわけではないが、神経や副鼻腔、肺病変と比べると死亡率の上昇に関連
・腎病変は20-25%に見られるが、MPAやGPAと比べると頻度が高くない
・腎生検では通常、pauci-immune型、巣状分節性、半月体形成性壊死性糸球体腎炎を呈するが、他のANCA関連血管炎と形態学的に見分けはつかない
・ANCA陽性と陰性のEGPAでは臓器病変の頻度が異なる
・ANCA陽性EGPAでは糸球体腎炎、肺胞出血および末梢神経障害が多い
・ANCA陽性EGPAでは臨床症状はMPAやGPAに似る
・ANCA陰性EGPAでは心病変が多い
・最近のGWAS(遺伝子調査)ではEGPAが2つの遺伝的および臨床的に異なるサブグループを含み(以下の表)、ANCA陽性EGPAではMPAと関連するMHCを共有している
・ANCA陰性EGPAでは喘息と遺伝的背景を共有している
《表:EGPAの遺伝的および臨床的サブグループ》

※ある報告(Mod Rheumatol 2012; 22: 394-404.)ではANCA陽性群(サブグループ1)は血管炎が主病態で、ANCA陰性群(サブグループ2)では好酸球性炎症が主病態と考えられている
【鑑別診断】
・他の小血管炎や好酸球性障害が鑑別となる
・他の小血管炎との鑑別では好酸球増多症や喘息の既往が鑑別点となる
・好酸球性障害では寄生虫感染、薬剤アレルギー、ホジキンリンパ腫などの血液悪性腫瘍などを除外する必要がある
・傷害臓器が肺に限局している場合、好酸球性肺炎とアレルギー性気管支肺真菌症を考慮する。いずれも喘息患者でしばしば発症し、移動性浸潤影を呈する
・好酸球増多症を伴い、肺外臓器障害が出現している場合、特発性好酸球増加症候群(HES)、IgG4関連疾患が重要な鑑別となる
・HESは通常アレルギー疾患の既往がない患者でも発症し、骨髄検査やFIP1L1-PDGFRα融合遺伝子の検査が必要
・IgG4関連疾患はIgG4分泌形質細胞、線維症を特徴とする局所・全身障害で、好酸球増多症と喘息を伴う場合もある
・組織病理学的検査がIgG4関連疾患の診断には不可欠で、血清IgG値の測定も役立つ
・HESやIgG4関連疾患でもACR1990やLanhamの分類基準を満たすことがあるため、ANCA陰性のEGPA例や組織病理学的検査で有意な所見が得られない場合では区別が困難の場合がある
【参考文献】
● Furuta S, et al. Allergol Int. 2019 Jun 29. pii: S1323-8930(19)30081-4. Update on eosinophilic granulomatosis with polyangiitis.