高齢発症のSLEを見たら、まず薬剤性ループスを疑います。外来に2名疑わしい患者さんがいるため、この疾患について久しぶりに知識をUpdateしました。
UpToDateが最もまとまっており、これに最新の論文を付け加えてまとめました。
歴史
●1945年にHoffmanが初めてスルファジアジンを使用した患者でループス様症状が出現した事を報告。
●現在までに100種類以上、10カテゴリー以上の薬剤が薬剤性ループスを起こすと言われている。
●以下に年代別薬剤誘発性ループスが報告された薬剤の一覧を示す(2)。
→注意すべきは、昔報告されている薬剤でも現在使用されていないものもある事!!

分類
●全身症状が出る全身性薬剤誘発性ループス、皮膚症状のみの薬剤誘発性皮膚エリテマトーデスに分けられる。
疫学
●SLEの内の10%が薬剤性と言われている(2)。
●米国では年間15000~30000人が薬剤性ループスを罹患する(2)。
●UpToDateでは性差はないが、文献(2)では女性男性比は4.3と女性に多い。
●発症年齢の中央値は49歳(2)で、特発性全身性エリテマトーデスよりも年齢が高い。
→ミノサイクリン誘発性ループスは例外で、ニキビ治療を受ける若年女性で発症する。
●黒人よりも白人に多い。
●プロカインアミド服用者の15~20%、ヒドララジン服用者の7~13%、抗TNFα阻害薬服用者の0.2%、ミノサイクリン服用者の0.05%に薬剤誘発性ループスが起こる。
→ただし、有病率は被疑薬を服用する集団に大きく依存。
●被疑薬の使用開始から薬剤性ループスの発症までは数か月~2年以内。平均172日(2)。
病因
●厳密な病因は不明だが、遺伝的要因、肝臓での薬物代謝(アセチル化)の速度、薬剤そのものの毒性、獲得免疫の影響(T細胞の活性化)、自然免疫の影響(好中球細胞外トラップ)などの関与が考えられている(4)。

遺伝的要因
●HLA-DR4、HLA-DR0301、補体C4ヌル対立遺伝子が遺伝的リスクである。
●プロカインアミド関連薬剤性ループスはHLA-DR6Yで見られる。
●ヒドララジン関連薬剤性ループスはHLA-DR4、補体C4ヌル対立遺伝子で見られる。
●ミノサイクリン関連薬剤性ループスはHLA-DQB1、HLA-DR2、HLA-DR4で見られる。
アセチル化効率の影響
●プロカインアミド、ヒドララジン、イソニアジドなどの薬剤はアセチル化によって代謝される(3)。
●薬剤性ループスはアセチル化の効率が悪い人(遅い人)で原因薬物が使用された時に早期に発症する。
●アセチル化が遅い要因として、遺伝的には肝臓でのN-アセチルトランスフェラーゼの合成の減少が関与する。
●プロカインアミドとヒドララジンはアセチル化効率が病因となり得るが、ミノサイクリンやTNFα阻害薬などの他の薬剤ではアセチル化の効率は病因とは関係ない。
●アセチル化効率は特発性SLEでは危険因子にはならない。
獲得免疫の影響
●プロカインアミド(反応性の代謝物を含む)やヒドララジンはT細胞の寛容を壊し、H2A-H2B-DNA抗体の形成をマウスモデルで誘導する事が分かっている。
●これらの薬剤は、DNAの低メチル化を起こす事で、リンパ球機能関連抗原-1(LFA-1)が過剰に発現され、自己反応性T細胞が産生される。
●プロカインアミドは直接的にT細胞でのDNAメチルトランスフェラーゼ1(DMNT-1)を抑制する。
●ヒドララジンはT細胞のERK経路を抑制し、間接的にDMNT-1発現を減少させる。
●しかし、T細胞のDNA低メチル化は薬剤誘発性ループスの初期のイベントではないという意見もある。
自然免疫の影響
●好中球細胞外トラップ(NETs)が薬剤誘発性ループスに関与するという報告もある。
●NETsが薬剤誘発性ループス患者の皮膚から発見されたという報告がある。
●プロカインアミドとヒドララジンはNET形成のトリガーとなり得る。
●プロカインアミドは好中球表面のムスカリン受容体の活性化を介してNET形成を引き起こす。
●Peptidylarginine deiminase 4(PAD4)は好中球でのクロマチン脱凝縮を仲介するカルシウム依存性酵素で、NET形成過程に重要だが、ヒドララジンは細胞内カルシウム値を変化させる事で、PAD4を活性化させ、NET形成を引き起こす。
●プロピルチオウラシルはNET形成を引き起こし、さらにその代謝も抑制する可能性がある。
自己抗体
●特定の薬物に関連する疾患ではヒストンタンパク質に特異性のある抗核抗体がするが、別の薬剤では抗ds-DNA抗体のように特発性SLEに頻繁に出現する抗体が出たり、全身性血管炎のようにANCAが出現する事もある。
抗ヒストン抗体
●プロカインアミド、ヒドララジン、クロルプロマジン、キニジンを服用している患者の全体の95%以上に存在する。
●ミノサイクリン、プロピルチオウラシル、スタチンなどの薬剤では少ない。
●抗ヒストン抗体は特発性SLE患者でも最大80%に見られるが、対応する抗原に差がある。
●薬剤誘発性ループスの抗ヒストン抗体はヒストン二量体H2A-H2BとDNAの複合体に対して形成される。ヒドララジンではH1とH3-H4複合体に対して抗体が形成される。
●プロカインアミド誘発性ループスではH2A-H2B-DNAに対する抗体の出現は薬剤誘発性ループス発症の前兆である(3)。この抗体がない場合は無症候性を保つ。
●特発性SLEでは抗ヒストン抗体は主にH1、H2Bヒストンサブユニットに対する抗体である。
→薬剤誘発性ループスと特発性SLEでは同じ抗ヒストン抗体でも対応抗原が異なる!!
●特発性SLEでは薬剤誘発性ループスではあまり見られないDNAやリポ核タンパク質などに対する自己抗体も形成する。
抗ds-DNA抗体
●プロカインアミド、ヒドララジン、イソニアジドによる薬剤誘発性ループスでは通常存在しないが、インターフェロンαやTNFα阻害薬では見られることがある。
抗SS-A抗体
●亜急性皮膚エリテマトーデスで見られる(>90%)(3)。
ANCA
●ミノサイクリンやプロピルチオウラシルで見られる。
●免疫染色ではP-ANCAが、標的抗原はMPO-ANCAが一番多い。
原因薬剤
全身性薬剤誘発性ループス
●主には5つのカテゴリーの薬剤が多い(抗不整脈薬、降圧薬、抗微生物薬、抗痙攣薬、免疫調整薬) (2)。
●2019年にARDから発表された論文(2)では118の被疑薬が抽出されている。

●なお、上記でICは『Infomation component』という医薬品と有害事象の因果関係の可能性を調べるための指標である。IC0.25はIC値の95%信頼区間の下限であり、これが正であることがその医薬品と副作用の間に因果関係がある事を示唆する。
●報告数は処方数に影響されるため、実際の因果関係を調べるためには上記の様な特殊な指標を用いるようである。
文献(3)より引用した頻度別の被疑薬の一覧を以下に示す。
●UpToDateでは最も頻度が高いのはプロカインアミド、ヒドララジンとされているが、2019年ARDから報告されている文献(2)ではTNFα阻害薬が最多、次いでプロカインアミド、ヒドララジンとなっている。
→ここ数年、TNFα阻害薬の使用数が増加した事による薬剤誘発性ループスの報告が多いためと考えられる!!

薬剤誘発性皮膚エリテマトーデス
亜急性皮膚エリテマトーデスSCLE)
●ヒドロクロロチアジド、ジルチアゼム、ACE阻害薬、スタチン、TNFα阻害薬、PPIに関連。
→薬剤誘発性ループスと原因薬剤が少し異なる!!
●その他、レフルノミド、ブプロピオン、アセブトロール、抗がん剤(カペシタビン、ウラシル-テガフール、パクリタキセル、ドセタキセル、タモキシフェン、アナストロゾール、ロイプロリド、ミトタン)、ラモトリギン、テルビナフィン、ニボルマブ
円板状ループス
●薬剤誘発性ループスでは稀。
●TNFα阻害薬、ウラシル-テガフールの症例報告あり。
ループス様皮膚反応
●ベンブロリズマブで報告あり。
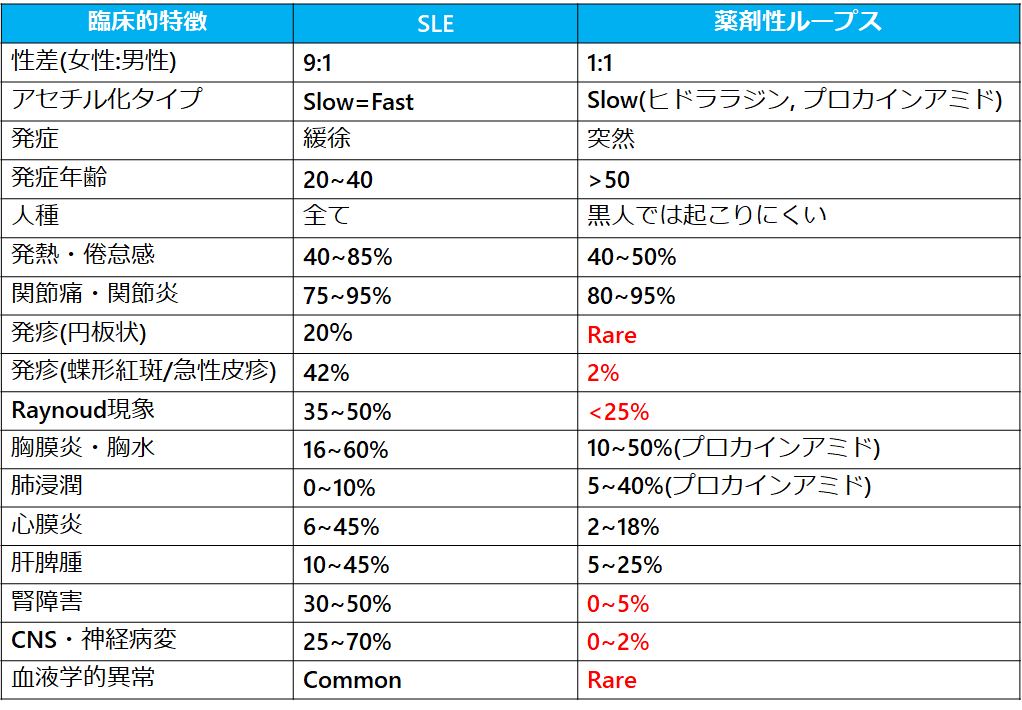
臨床症状と検査所見
全身性薬剤誘発性ループス
●多くは長期間(プロカインアミドとヒドララジンの場合>3年(3))、被疑薬を服用している場合に起こるが、以前使用したことがある場合は薬剤開始後、数日以内に起こる事がある。
●症状は全身症状(発熱、食思不振、体重減少、倦怠感)、筋骨格系症状(筋肉痛、関節痛、関節炎)、漿膜炎、皮膚症状などが一般的だが、薬剤によって頻度が異なる。
●突然起こる事もある。
●基本は特発性SLEよりも症状が軽い(3)。
●腎病変や中枢神経病変、消化器病変、血液学的異常は稀(3)。
●胸膜炎はプロカインアミド誘発性ループスの約50%、キニジン誘発性ループスの22%、ミノサイクリン誘発性ループスの1%未満で起こる。
●皮膚症状はTNFα阻害薬で多く(>80%)、その他、ヒドララジンやキニジンでも1/3の患者で見られる(3)。プロカインアミドやミノサイクリンでは稀。
●低補体血症や抗DNA抗体の出現も珍しい(インターフェロンα、TNFα阻害薬使用者ではしばしば抗DNA抗体がみられる)。
特定の薬剤誘発性ループスの臨床症状
プロカインアミド
●プロカインアミドを2年以上服用している患者ではほぼ全員が抗核抗体が陽性となる。
●アセチル化が遅い患者ではより早く陽性化する。
●プロカインアミドを1年以上服用している患者の1/3に症状が出現する。
●胸膜炎±肺浸潤影を含む肺病変が典型的。時に心膜炎なども(3)。
ヒドララジン
●ヒドララジンを服用する患者の5~10%に臨床症状が出現する。
●低用量でも安全ではない。アセチル化効率が悪い患者では100mg/日服用した場合、5%に臨床症状が出現する。
●ヒドララジンはANCA関連血管炎や糸球体腎炎とも関連している可能性がある。
ミノサイクリン
●他のテトラサイクリンとは異なり、ニキビ治療を受けている若年女性の間で薬剤誘発性ループスを引き起こしている。
●発症リスクは比較的少なく(HR2.6~3.1)、絶対リスクは内服者1000人中1人のみ。
●特徴は関節痛(73~100%)、関節炎(12~45%)、発熱(38%)、発疹(29%)、その他、朝のこわばり、筋肉痛、肺炎、皮膚血管炎など。
●ミノサイクリン誘発性ループスでは32~54%で肝障害が発生する可能性がある。
●他の薬剤とは異なり、抗ds-DNA抗体、P-ANCAがそれぞれ92%、83%陽性となるが、抗ヒストン抗体は一般的ではない(0~13%)。
●ほとんどの症状は薬剤中止後、比較的短期間で消退するが、幼児はミノサイクリン曝露後、長期に渡り、疾患リスクが高くなる可能性がある。
●SLE患者ではミノサイクリンを避ける医者もいる。
TNFα阻害薬
●キメラ抗体のインフリキシマブが多いがその他でも報告は少なくない。
●ANAはインフリキシマブ治療患者の31~63%、アダリムマブ治療患者の16~51%、エタネルセプト治療患者の12~48%に見られた(3)。
●ほとんどの症例は抗ds-DNA抗体、抗Sm抗体、抗ヒストン抗体の形成する。
●症状は皮膚、胸膜の異常が多いが、腎、神経病変は比較的稀。
●ほとんどの患者ではTNFα阻害薬中止後に症状は完全に消退する。
亜急性皮膚エリテマトーデス(SCLE)
●特発性の亜急性皮膚エリテマトーデス患者の内、かなりの割合が薬剤誘発性である。
●薬剤誘発性ループスの30%を占める。
●薬剤誘発性SCLEの大多数(70~90%)は抗SS-A/Ro抗体が陽性であった。
●抗SS-B/La抗体も陽性となる。
●薬剤誘発性SCLEは通常、輪状または乾癬状の光分布性皮膚発疹として出現する。
ANCA関連血管炎と腎疾患
●薬剤誘発性ループスの腎病変のほとんどは免疫複合体の沈着がほとんどない壊死性糸球体腎炎によるものだが、免疫複合体を介した糸球体腎炎が発生することもある。
●壊死性糸球体腎炎の患者は通常、抗ミエロペルオキシダーゼ(MPO)抗体に加えて抗ラクトフェリン抗体、抗エラスターゼ抗体(非定型P-ANCA)のいずれかが陽性となり、免疫蛍光顕微鏡でP-ANCAパターンを示す。
●ANCAのこの組み合わせはヒドララジン誘発性ループスに比較的特異的である。
●これらの患者ではヒドララジン誘発性ループスの典型的患者では稀な抗ds-DNA抗体を持っている可能性がある。
●ミノサイクリン治療後にC-ANCA力価陽性、PR3-ANCAが上昇するpauci-immune型半月体形成性壊死性糸球体腎炎を起こした報告もある。
●ANCAは特発性SLEの15~20%でも見られる。
●薬剤性ANCA関連血管炎は一般的にコカインのコンタミ物質としてのレバミソールを含む他の薬剤からも生じる可能性があり、関節痛、皮膚症状を引き起こす。
診断
●確固たる診断基準はない。
●血算、腎機能、肝機能、尿検査、抗核抗体、抗ds-DNA抗体、抗Sm抗体、抗RNP抗体、抗SS-A/Ro抗体、抗SS-B/La抗体、抗ヒストン抗体(日本では測定できない)などを提出する。
●ミノサイクリン、ヒドララジン、プロピルチオウラシル、メチマゾールを使用中の患者ではANCAも提出する。
●以下の場合は薬剤誘発性ループスを疑う。
・被疑薬を内服している(2)。
・SLEの症状を少なくとも1つ以上あり、1か月以上持続している。
→分類基準を満たす必要はない。
・被疑薬服用前にSLE症状の既往がない(2)。
・抗核抗体が陽性(ANCAは特定の薬剤で陽性となる)。
→抗ヒストン抗体は陽性となるが、抗ds-DNA抗体はほとんど陰性。
・症状が被疑薬中止後、数週間から数か月以内に消退する
→抗核抗体は多くの場合、症状よりも長期間持続し、一部では1年以上
も陽性が持続する。
●薬剤誘発性亜急性皮膚エリテマトーデス(SCLE)の診断は特徴的な臨床所見を持つ患者では容易である。疑わしい薬剤を中止し、皮膚の変化が改善するかを見る。
●薬剤誘発性亜急性皮膚エリテマトーデス患者では抗SS-A抗体が陽性となる。
鑑別診断
●特発性の全身性エリテマトーデスが最大の鑑別。
●腎病変、神経病変、消化管病変、重度の血液学的異常は薬剤誘発性ループスではあまり一般的ではない(皮膚に関してはSCLEの場合は除外)。
●抗ヒストン抗体はSLEでも薬剤誘発性ループスでも見られる(対応抗原が異なる)。

治療と予後
●原因薬剤の中止が第一。ほとんどは中止で改善する。
●関節痛、関節炎、漿膜炎にはNSAIDs、皮疹には局所グルココルチコイド。
●治療抵抗性や全身性、皮膚、筋骨格系の症状が4~8週間以内に改善されない場合は抗マラリア薬(ヒドロクロロキン)を一時使用する。
●グルココルチコイドは稀にしか必要とされないが、重篤な胸膜炎、心膜炎に有効。
●主要臓器の障害(糸球体腎炎、CNS病変、重篤な血液学的異常)では薬剤の中止だけでなく、SLEのようにコルチコステロイド大量療法、免疫抑制療法などが使用される。
●ヒドララジン誘発性血管炎の場合もANCA関連血管炎のようにしばしば免疫抑制療法を必要とする。
●自己抗体の抗体価はゆっくり減少し、長時間陽性が持続する可能性があるため、治療指標にはしない(3)。
●治療が数か月必要な事もあるが、予後は比較的良好。
●死亡は1.8%のみ(2)。
●被疑薬の再使用はしない。
特発性SLE患者への影響
●SLE患者における薬剤誘発性ループスに関連する薬剤の安全性は不明。
●これらの薬剤を回避する事を支持する根拠はない。
●TNFα阻害薬の長期使用は高率(50%)に抗核抗体(抗ds-DNA抗体)を誘導する。
●ただしほとんどはIgMサブクラスであり、臨床症状が出ることは稀で発症しても軽度。
●薬剤使用における一過性の自己抗体形成はSLEフレアと相関しない。
●稀にループス腎炎はTNFα阻害薬使用中の患者で報告されている。
まとめ
●薬剤誘発性ループスは、全身症状が出る全身性薬剤誘発性ループス、皮膚症状のみの薬剤誘発性皮膚エリテマトーデスに分けられる。
●SLEの内の10%が薬剤性と言われている。
●発症年齢は特発性全身性エリテマトーデスよりも高い。
●被疑薬の使用開始から薬剤性ループスの発症までは数か月~2年以内。平均172日。
●厳密な病因は不明だが、遺伝的要因、肝臓での薬物代謝(アセチル化)の速度、薬剤そのものの毒性、T細胞の活性化、好中球細胞外トラップなどの関与が考えられている。
●SLE同様、抗ヒストン抗体が陽性となるが、対応している抗原が異なる。
●インターフェロンαやTNFα阻害薬では抗ds-DNA抗体、ミノサイクリンやプロピルチオウラシルではANCA、亜急性皮膚エリテマトーデスで抗SS-A抗体が陽性となる。
●2019年現在、118種類の被疑薬が存在し、主には5つのカテゴリーの薬剤が多い(抗不整脈薬、降圧薬、抗微生物薬、抗痙攣薬、免疫調整薬)。
●全身性薬剤誘発性ループスでは原因薬剤としてTNFα阻害薬が最多、次いでプロカインアミド、ヒドララジンが多い。
→TNFα阻害薬の報告はここ数年特に処方の増加に比例して多くなっている。
●亜急性皮膚エリテマトーデスではヒドロクロロチアジド、ジルチアゼム、ACE阻害薬、スタチン、TNFα阻害薬、PPIに関連する。
●症状は全身症状(発熱、食思不振、体重減少、倦怠感)、筋骨格系症状(筋肉痛、関節痛、関節炎)、漿膜炎、皮膚症状などが一般的だが、薬剤によって頻度が異なる。
●プロカインアミドでは胸膜炎、ヒドララジンでは血管炎や糸球体腎炎、ミノサイクリンでは関節炎、肝障害、TNFα阻害薬では皮膚症状が生じやすい。
●腎病変、中枢神経病変、消化器病変、血液学的異常は稀。
●基本は特発性SLEよりも症状が軽い。
●確固たる診断基準はないが、以下の場合は薬剤誘発性ループスを疑う。
・被疑薬を内服している。
・SLEの症状を少なくとも1つ以上あり、1か月以上持続している。
・被疑薬服用前にSLE症状の既往がない。
・抗核抗体が陽性(ANCAは特定の薬剤で陽性となる)。
・症状が被疑薬中止後、数週間から数か月以内に消退する
●薬剤中止でほとんど改善するが、皮膚症状が持続する場合には抗マラリア薬、腎、神経、重篤な血液学的異常がある場合はステロイド大量+免疫抑制療法も検討する。
●薬剤誘発性ループスの被疑薬の特発性SLEへの影響は分かっていない。
【参考文献】
(1) UpToDate, "Drug-induced lupus" last update Jan 21, 2019.
(2) Arnaud L, et al. Ann Rheum Dis. 2019 Apr; 78 (4): 504-508. "Drug-induced systemic lupus: revisiting the ever-changing spectrum of the disease using the WHO pharmacovigilance database."
(3) Vaglio A, et al. Autoimmun Rev. 2018 Sep; 17 (9): 912-918. "Drug-induced lupus: Traditional and new concepts."★★
(4) He Y, et al. Curr Opin Rheumatol. 2018 Sep; 30 (5): 490-497. "Drug-induced lupus erythematosus: an update on drugs and mechanisms"