【永久保存版】メトトレキサートの作用機序~Nature Reviews Rheumatology 2020~
関節リウマチ治療の中心的役割のメトトレキサートについてまとめている論文を和訳しました。メトトレキサート治療に関わる全ての医療者に読んでいただきたい内容です。
薬理学
●メトトレキサートの半減期は経口では約6時間、非経口でも18時間経過したら、血清では検出されない(PMID=2715941)。
●メトトレキサートの生物学的利用能は腸での吸収能に依存しており、単回経口投与によって最大<25mg吸収される(PMID=28012023)。
●メトトレキサートはメトトレキサートと7-ヒドロキシメトトレキサート(主要な代謝物)の両方として尿中に排泄される。
●メトトレキサートモノグルタミン酸(天然型)は細胞内でグルタミン酸を添加されてポリグルタミン酸となる(下図)。メトトレキサート-ポリグルタミン酸は何週間も組織で検出される。

a: 葉酸とメトトレキサート、アミノプテリンは構造的に似ている事を示しています。
b: 細胞内でメトトレキサート-モノグルタミン酸がフォリルポリグルタメートシンターゼ(FPGS)によって可逆的にポリグルタミン酸に変化します(反対の反応はペプチダーゼγ-グルタミル加水分解酵素(GGH)が担います)。
●メトトレキサート-ポリグルタミン酸はメトトレキサートの活性型であり、多くの酵素の阻害薬として働く(天然型の効力と異なる)。
●5-アミノイミダゾール-4-カルボキサミドリボヌクレオチド(AICAR)のトランスフォーマイラーゼ(ATIC)はde noveプリン生合成の最後の段階を触媒するが、メトトレキサート-ポリグルタミン酸の良い阻害対象である。
→メトトレキサート-ポリグルタミン酸はメトトレキサート-モノグルタミン酸の2000倍以上強力である。
●その他にもメトトレキサート-ポリグルタミン酸は葉酸依存性酵素が関与するde novo プリン、ピリミジン合成を阻害する(下図a)。
●またトランスメチル化反応、ポリアミン合成に関与する酵素も阻害する(下図c)。
作用機序
●当初DNAやRNAの合成に必要なプリン、ピリミジンのde novo合成の阻害により悪性腫瘍や非悪性腫瘍細胞の増殖を阻害する目的で作られた。
●以前はアメトプテリンとして知られていたメトトレキサートはアミノプテリンの類似体である。
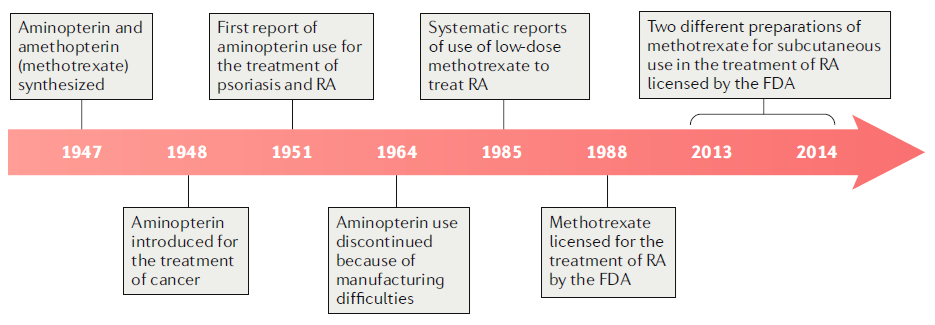
●両者は1948年にまず白血病やその他の悪性腫瘍の治療目的で最初に高用量で使用され、1951年に初めて関節リウマチにアミノプテリンが化学療法量で使用された。
●アミノプテリンは製造上、困難があり、市場から排除され、メトトレキサートのみが残った。
●1960年代から1970年第にかけて重度の乾癬の治療に低用量のメトトレキサートが使用され、その後、関節リウマチにまで拡大された。
●1980年代半ばにはメトトレキサートは関節リウマチで臨床試験がなされ、1988年にFDAによって認可された。
●経口薬のバイオアベイラビリティが限られているという認識のため、2つの非経口薬(皮下注製剤)が2013年、2014年に開発、承認された。
※日本では1999年にリウマトレックスの名前で認可されました。
●メトトレキサートの作用機序としては、プリン、ピリミジンを抑えるメカニズムに加えて(下図a)、アデノシン放出の増強(下図b)、一部の細胞で必要なトランスメチル化反応の抑制(下図c)、ポリアミン蓄積の減少(下図c)、一酸化窒素合成酵素脱共役(下図d)など、様々な作用機序が仮定されている。
●メトトレキサートは好中球、単球、T細胞、B細胞、内皮細胞、線維芽細胞様滑膜細胞(FLS)など、炎症に関わるほぼすべての細胞の機能を直接的、間接的に調整する。
代謝への作用
プリン、ピリミジン合成阻害
●メトトレキサートはDNAやRNAの構成要素であるプリン、ピリミジンのde novo合成に重要な葉酸依存性酵素の経路を標的にしている。
●循環白血球(好中球、リンパ球)と急速な増殖が必要な骨髄中の前駆細胞数の減少は、抗腫瘍薬としてのメトトレキサート量で起こるが、メトトレキサートの副作用として起こる末梢白血球数の減少は、悪性腫瘍で用いられる量の100分の1から1000分の1の用量で起こる。
●葉酸やフォリン酸の投与はこの毒性を予防できる。
●これらの補充はメトトレキサート服用中の関節リウマチのフレアにつながる事が報告されているが(PMID=1768158)、メタアナリシスではこの関連性はサポートされていない(PMID=3260783)。
●葉酸やフォリン酸を同時補給することで末梢白血球数の減少を防いでいる状態でも、メトトレキサートの効果が認められる事を考えると、メトトレキサートの抗炎症効果が細胞増殖の抑制のみを必要とする可能性は低い。

dTMP:デオキシチミジン一リン酸、dUMP:デオキシウリジン一リン酸、FAICAR:ホルミルAICAR、FRβ:葉酸受容体-β、GGH:γ-グルタミル加水分解酵素、PCFT:プロトン結合葉酸トランスポーター、THF:テトラヒドロ葉酸
a: メトトレキサートは、還元型葉酸キャリア1(RFC1)を介して細胞に取り込まれ、ホリルポリグルタミン酸合成酵素(FPGS)によってポリグルタミン酸化される。メトトレキサート-ポリグルタミン酸は細胞内に蓄積し、ジヒドロ葉酸還元酵素(DHFR)、メチレンテトラヒドロ葉酸還元酵素(MTHFR)、チミジル酸合成酵素(TYMS)、5-アミノイミダゾール-4-カルボキサミドリボヌクレオチド(AICAR)トランスフォーマイラーゼ(ATIC)によって媒介されるものを含む多くの酵素反応を阻害できる。 それによりプリンとピリミジンの生合成を減少させる。
トランスメチル化反応の阻害
●スペルミンやスペルミジンなどのポリアミンは、滑膜組織、関節液、単核細胞、関節リウマチ患者の尿に蓄積する。
●単球はこれらのポリアミンをアンモニアやH2O2に加水分解でき、それらはサイトトキシンとして細胞や関節組織を傷害する。
●メトトレキサートはジヒドロ葉酸還元酵素(DHFR: ジヒドロ葉酸からテトラヒドロ葉酸への還元を媒介する酵素)を阻害し、メチルドナー(供給体)であるテトラヒドロ葉酸、5-メチルテトラヒドロ葉酸の形成を減少させ、ポリアミンの合成を減少させる(図c)。
●一つの仮説として、メトトレキサートによるトランスメチル化反応の阻害と、それによってポリアミン産生が減少することによって、下流でアンモニアとH2O2の産生が減少し、それによって滑膜損傷が減少するというものである。
●ただし、関節リウマチの治療薬として直接トランスメチル化阻害薬である3-デアザアデノシンの臨床試験では効果は十分得られなかったことからは、トランスメチル化反応の阻害は炎症性疾患におけるメトトレキサートの抗炎症作用のわずかな部分しか担っていないことを意味している。

SAH:S-アデノシルホモシステイン、SAM:S-アデノシルメチオニン、THF:テトラヒドロ葉酸
c: メトトレキサートは、ポリアミンの合成を阻害する(メチルドナーである5-メチルテトラヒドロ葉酸(5-CH3-THF)の濃度が低下しているため)。
アデノシン放出
●5-アミノイミダゾール-4-カルボキサミドリボヌクレオチド(AICAR)のトランスフォーマイラーゼ(ATIC)はメトトレキサート-ポリグルタミン酸によって強力に抑制される。それによりAICARは組織に蓄積する。
●AICARはAMPデアミナーゼ(AMPDA)とアデノシンデアミナーゼ(ADA)を阻害し、細胞外空間へのアデニンヌクレオチドを放出させる。
●アデニンヌクレオチドは細胞表面酵素であるエクトヌクレオチド三リン酸デホスホリラーゼI(CD39としても知られる)と、エクト-5'-ヌクレオチダーゼ(CD73としても知られる)の作用によってアデノシンに変換される。
●アデノシンはアデノシン受容体A1a、A2a、A2b、A3に強力に作用し、ほぼ全ての炎症細胞に対して強力な抑制効果を発揮する。
●メトトレキサートはマウスに投与すると、アデノシンが増加し、抗炎症作用を発揮し、選択的アデノシン受容体A2a拮抗薬を投与すると、効果が減弱する実験がある(PMID=8254024)。
●アデノシン受容体A2a、A3が欠損していたり、CD73が欠損している場合はメトトレキサートは抗炎症作用を発揮しない。
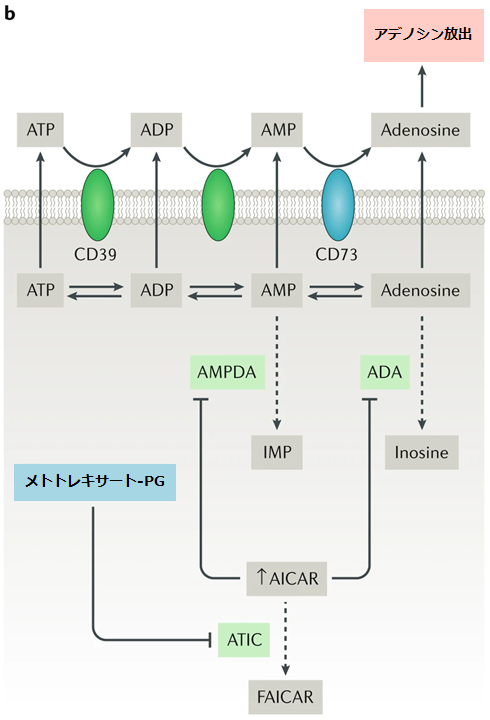
FAICAR:ホルミルAICAR、IMP:イノシン一リン酸
b: メトトレキサートを介したATICの阻害は、細胞内AICARの蓄積を引き起こし、最終的にはAMPデアミナーゼ(AMPDA)およびアデニンデアミナーゼ(ADA)の活性が低下するため、細胞外アデノシンレベルが上昇する。
●アデノシンの産生は、制御性T細胞(Treg)が細胞性免疫や炎症を減少させるメカニズムの一つとして考えられている(PMID=27829671)。
●アデノシンはCD39やCD73を媒介して脱リン酸化されたATPを介して制御性T細胞によって産生される。
●T細胞上のCD39が低発現だと、メトトレキサートへの反応性が下がるという報告がある(PMID=25675517)。
●B細胞によってメトトレキサートを介して放出されたアデノシンは、B細胞活性化因子(BAFF)依存的に治療用のモノクローナル抗体(抗TNF抗体など)に対する免疫力の低下をもたらす(PMID=29936438)。
→抗TNF阻害薬とメトトレキサートを併用する事で抗薬剤抗体の産生抑制のメカニズムと考えられている。
●その他、アデノシンには下表のような抗炎症作用がある(PMID=27829671)。

一酸化窒素合成酵素の脱共役
●ジヒドロ葉酸還元酵素(DHFR)はジヒドロ葉酸からテトラヒドロ葉酸への還元を触媒することに加えて、ジヒドロビオプテリン(BH2)からテトラヒドロビオプテリン(BH4)への還元も触媒する。
●メトトレキサートはDHFRを阻害する事でジヒドロ葉酸とBH2の両方の還元を阻害する。
●BH4は全ての一酸化合成酵素(1-アルギニンからの一酸化窒素の生成を触媒する酵素ファミリー)に必要な補因子。
●BH4がないと、一酸化窒素合成酵素は一酸化窒素ではなく、過酸化水素などの活性酸素種を生成する。これを『一酸化窒素合成酵素の脱共役』と言う。
●増加した活性酸素種はJUN N末端キナーゼ(JNKs)を活性化し、転写因子JUNのリン酸化を増加させ、JUN-FOSヘテロダイマーアクチベーター蛋白1(AP1)の転写活性を増加させる。
●この転写因子(AP1)はアポトーシスや他の多くの細胞プロセスの重要な調整因子である。
●AP1の活性化によりTP53、CDKN1A、CDKN1B、CHEK2、BCL3、HRKなど、細胞周期の停止を誘導してアポトーシスに対する感受性を促進する蛋白をコードする遺伝子が誘導される。
●HRKは、アポトーシス阻害作用のあるBCL-2、BCL2L1と相互作用してアポトーシスを促進するタンパク質、アポトーシス・ハラキリ(apoptosis harakiri)の活性化因子をコードしており、メトトレキサート刺激に応答して T 細胞のアポトーシス感受性が増加することが説明できる。
●T細胞では、メトトレキサートはTNF刺激による核内因子κB(NF-κB)転写活性の上昇も抑制するが、これは主要な炎症性シグナル伝達経路である。
●メトトレキサートによるNF-κB活性化の阻害は、上述の経路を介してJNK依存性のp53のアップレギュレーションを介して起こる。
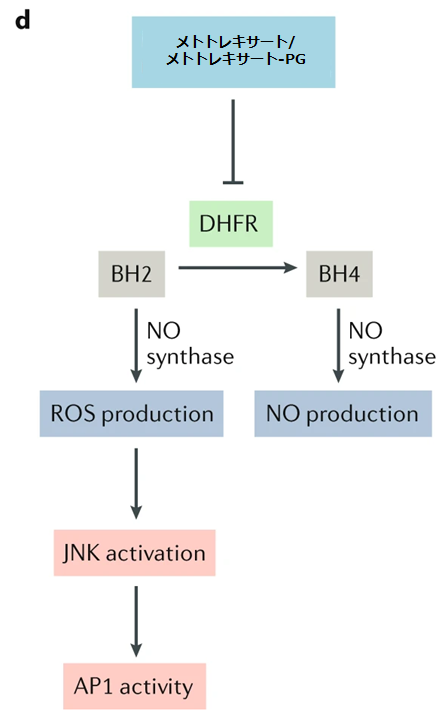
BH2:ジヒドロビオプテリン
d: メトトレキサートによるDHFR阻害は、テトラヒドロビオプテリン(BH4)の産生を阻害し、それによって『一酸化窒素合成酵素の脱共役』として知られるプロセスで一酸化窒素(NO)の産生を減少させ、活性酸素種(ROS)の産生を増加させる。JUN N末端キナーゼ(JNK)の活性化の増加は、アクチベータータンパク質1(AP1)の活性を促進し、NF-κBの活性化を阻害する。
LincRNA-p21の発現
●新しいデータはメトトレキサートがいくつかの長鎖ノンコーディングRNA(lncRNA)の発現を調整する事を示している。
●一例として、長鎖ノンコーディングRNAp21(lincRNA-p21)は、CDKNIA(p21をコードする)に隣接する遺伝子によってコードされているため、その名前が付けられているが、DNA損傷応答の一部としてp53によって誘導される。
●LincRNA-p21はアポトーシス阻害蛋白質をコードする多数の遺伝子の転写を抑制する事によって、p53を介したアポトーシス応答を調節する。
●そのため、lincRNA-p21はアポトーシスの適切な誘導には必要である。しかし、細胞周期の調節には影響を与えないようである。
●これは、DNA損傷やその他の細胞ストレスに応答してp53によって調節される2つの中心的な経路である。
●LincRNA-p21は低酸素症によっても誘導され、Warburg効果を促進する低酸素症に対する細胞応答の重要なメディエーターである転写因子HIF1αの発現も促進させる。
●細胞質ではlincRNA-p21の追加の機能は、選択したターゲットmRNAに結合して、リボソームへの動員と蛋白質への翻訳阻害である。
●よってlincRNA-p21は様々な生物学的プロセスを調整する多機能lincRNAである。
●p53とlincRNA-p21の両方の循環濃度は関節リウマチ患者で減少し、メトトレキサート療法中に健常者と同じレベルに回復する(PMID=25077978)。
●T細胞ではメトトレキサートはlincRNA-p21の発現を誘導する(下図)。

●T細胞におけるメトトレキサートによるlincRNA-p21の誘導は一酸化窒素合成酵素の脱共役またはアデノシン放出とアデノシン受容体の活性化の結果ではなく、DNA依存性プロテインキナーゼ(DNA-PK)の活性化に依存する。
●メトトレキサートがどのようにDNA-PKを活性化するかは明らかになっていないが、DNA-PKの阻害はメトトレキサートを介したlincRNA-p21の誘導を明らかに無効にする。
●T細胞において、lincRNA-P21はNF-κBの活性を阻害するが、NF-κB の主要な構成要素をコードする遺伝子 RELA や NFKB1 を標的としたり、NF-κB 活性化につながる細胞内シグナル伝達経路を破壊したりすることはない。
●むしろ、lincRNA-p21はRELA mRNAに結合してその翻訳を阻害するため、TNFなどの外部炎症性刺激に応答して転写活性化を媒介するために利用可能なNF-κBの量を減少させる。
●この考えと一致するように、メトトレキサート治療を受けているRA患者は、メトトレキサート治療を受けていないRA患者に比べてNF-κBサブユニットp65(RELAによってコードされる)のレベルが大幅に低下している。
●このように、lincRNA-p21の誘導もRAにおけるメトトレキサート治療の有効性に寄与している可能性がある。
JAK-STATシグナル伝達の阻害
●IL-6や他の刺激は、炎症性シグナルの様々な生産を刺激する受容体関連ヤヌスキナーゼ(JAK)によるシグナル伝達物質や転写(STAT)タンパク質のリン酸化につながる重要なシグナル伝達系を活性化する。
●ハイスループットのスクリーニングデータに基づくと、メトトレキサートとそのアナログであるアミノプテリンは、ショウジョウバエ細胞のJAK1-STAT3とJAK2-STAT5転写経路を介してシグナル伝達を阻害することが示され、その後、ヒトのマクロファージ細胞でも示された(PMID=31313387/26131691)。
●葉酸がメトトレキサートを介したSTAT5リン酸化の阻害を抑制できず、さらに様々な葉酸依存性の酵素をknock downしても、メトトレキサートのSTAT5リン酸化阻害効果に影響を及ぼさなかったため、メトトレキサートのJAK-STAT阻害効果は葉酸に依存しないことが示唆された(★PMID=26131691)。
●これらの細胞におけるメトトレキサート治療が、JAKを介したSTAT3やSTAT5のリン酸化を直接阻害するのか、あるいは他の細胞内因子が関与しているのかは不明である(メトトレキサートの効果の試験は全細胞でのみなされたため)。
●本報告の著者らは、メトトレキサートで治療した末梢血CD4+ T細胞、B細胞および単球では、STATリン酸化が中程度にしか阻害されなかったことを指摘しており、メトトレキサートのJAK-STATシグナル伝達に対する効果は、患者のこの炎症性シグナル伝達経路を減衰させる可能性はあるが、完全には阻害されないことを示唆している。
NF-κBシグナルの阻害
●NF-κB の活性化と核内転座は、多くの組織や細胞型における炎症や炎症性変化の中心的な機能を持っている。
●すでに述べたように、アデノシンは、単球、マクロファージ、内皮細胞などの様々な細胞型や組織における NF-κB 活性化の直接的な阻害を含む、メトトレキサートの抗炎症作用の多くを媒介すると考えられている。
●また、前述したように、メトトレキサートは、T細胞におけるRELAの発現(lincRNA-p21の発現促進を介して)を低下させ、BH4枯渇とJNKの活性化を促進することにより、NF-κBの活性化を阻害することができる。
●全ゲノム関連研究では、炎症性関節炎患者におけるメトトレキサートに対する好ましい反応と関連するTNFAIP3(NF-κB活性化の重要な抑制因子であるA20をコードする)の一塩基多型が同定された。
●最近の研究では、顆粒球-マクロファージコロニー刺激因子(GM-CSF)のみで刺激されたマクロファージが、他の刺激ではなく、チミジル酸合成酵素とp53を媒介するメカニズムを介して、メトトレキサート治療に直接反応したこと、GM-CSFで刺激されたマクロファージがメトトレキサートに反応してA20をアップレギュレートし、より『寛容』になったことを発見した。
●このように、メトトレキサート治療がNF-κBの活性化および下流の炎症性機序の発現を抑制するメカニズムは複数存在する。
●これらのメカニズムのいくつかは、特定の細胞型に限定されているよう(例えば、T 細胞におけるlincRNA-p21とA20の誘導、GM-CSFで刺激したマクロファージ、など)。一方、アデノシンは、複数の細胞型においてNF-κBの活性化に影響を与える。
細胞への作用
T細胞への効果
●関節リウマチ患者のT細胞は細胞周期チェックポイントシグナルやアポトーシスに抵抗性があると言われている。
●関節リウマチでは細胞周期チェックポイントプログラムやアポトーシスに重要な蛋白質をコードする遺伝子の発現と機能が低下している。
●これらの遺伝子の発現レベルはメトトレキサート治療を受けている患者では正常または健常者と同じレベルに回復する(PMID=21618198/22183962)。
●このような遺伝子の例としては、TP53、CDKN1A、CDKN1B、CHEK2などが挙げられるが、T細胞においては、これらの遺伝子はサブマイクロモル濃度でメトトレキサートによって直接誘導され、RA患者の治療効果が示されている濃度と同程度であり、メトトレキサートによるチェックポイントのリプログラミングがメトトレキサートの治療効果に寄与している可能性が示唆されている。
●このような条件下では、メトトレキサートはT細胞の細胞周期停止やアポトーシスを直接誘導することはない。むしろ、メトトレキサートはT細胞のアポトーシスに対する感受性を著しく増大させる。

a: T細胞では、メトトレキサートはジヒドロ葉酸レダクターゼ(DHFR)を介したジヒドロビオプテリン(BH2)のテトラヒドロビオプテリン(BH4)への還元を阻害し、一酸化窒素合成酵素(NOS)の脱共役と活性酸素種(ROS)の生成を増加させる。ROSはJUNN末端キナーゼ(JNK)を活性化し、活性化されたJNKは、アポトーシスと細胞周期の進行に対する感受性を調節するタンパク質をコードする遺伝子を誘導する。T細胞では、メトトレキサートは未知のメカニズムによってDNA依存性プロテインキナーゼ(DNA-PK)も活性化し、長鎖ノンコーディングRNA p21(lincRNA-p21)の誘導を引き起こします。LincRNA-P21は、RELA mRNAの翻訳を阻害し、炎症誘発性転写因子である核内因子-κB(NF-κB)のレベルを低下させ、炎症を抑制する。
●このように、関節リウマチ患者のT細胞のアポトーシスに対する抵抗性は、メトトレキサート治療によって逆転する可能性がある。
●また、関節リウマチ患者のT細胞では、炎症性転写因子NF-κBの活性化が顕著であるが、メトトレキサート治療を受けている患者では、この慢性的な活性が改善されている(前述の通り)。
●メトトレキサートによる慢性的に活性化したNF-κBの阻害は、メトトレキサートが抗炎症作用を持つ転写因子であるp53の発現を誘導またはlincRNA-p21の発現を誘導することに起因していると考えられる。
線維芽細胞様滑膜細胞への効果
●線維芽細胞様滑膜細胞は関節リウマチの病因にも関与しており、これらの細胞でNF-κBが高いレベルで活性化している(PMID=27881147/20193003)。
●線維芽細胞様滑膜細胞におけるNF-κB活性の高さは、線維芽細胞様滑膜細胞の増殖、血管新生、炎症特性に寄与していると考えられている。
●メトトレキサートは、この線維芽細胞様滑膜細胞におけるNF-κB活性を阻害する。
●しかし、メトトレキサートは、BH4枯渇や一酸化窒素合成酵素の脱共役を介して線維芽細胞様滑膜細胞のNF-κB活性を阻害するのではなく、むしろメトトレキサートによって刺激されたアデノシンの放出とそれに続くアデノシン受容体の活性化が、線維芽細胞様滑膜細胞における高いベースラインレベルのNF-κB活性を阻害しているようである。

b: 線維芽細胞様滑膜細胞では、メトトレキサートもNF-κB活性を阻害するが、この効果は、5-アミノイミダゾール-4-カルボキサミドリボヌクレオチド(AICAR)トランスフォーマイラーゼ(ATIC)の阻害、アデノシン放出の増加、および同じ細胞上のアデノシン受容体の活性化を介して発生する。 結果としてNF-κBの阻害とそれに続く抗炎症作用が引きおこる。
●T細胞と線維芽細胞様滑膜細胞の間でメトトレキサートに対する反応が異なるのは、一酸化窒素合成酵素の量が異なるためと考えられ、T細胞は一酸化窒素合成酵素活性が高く、一酸化窒素合成酵素脱共役経路が優勢であり、線維芽細胞様滑膜細胞は一酸化窒素合成酵素活性が低く、アデノシン-アデノシン受容体経路が優勢である。
●このように、メトトレキサートは線維芽細胞様滑膜細胞においてもNF-κB活性を阻害することから、関節リウマチの治療効果が期待できると考えられている。
単球への効果
●メトトレキサートの効果は、単球細胞株でも検討されている81。T細胞やFLSとは対照的に、単球はメトトレキサートに反応してアポトーシスを起こす。
●さらにメトトレキサートは、単球細胞株においてIL-1、TNF、IL-6を含む炎症誘発性サイトカインの発現を用量依存的に増加させる(PMID=24444433)。
●メトトレキサートによるこれらの炎症性サイトカインの誘導は、ジヒドロ葉酸のテトラヒドロ葉酸への還元を阻害することによるものであり、BH2のBH4への還元や一酸化窒素合成酵素の『脱共役』やアデノシン受容体シグナル伝達の促進を阻害することによるものではないと考えられている。

c: 単球では、メトトレキサートはアポトーシスを促進し、DHFRを介したジヒドロ葉酸(DHF)からテトラヒドロ葉酸(TTF)への還元の阻害を介して発生する可能性のある、未知のNF-κB依存性メカニズムを介して炎症誘発性サイトカインの発現を増加させることができる。
●この効果は臨床的に意味を持ち、これらの炎症性サイトカインによって媒介される可能性のある粘膜の炎症や肺炎などのメトトレキサートの副作用のいくつかを説明するのに役立つ。
●アデノシンはまた、アデノシン受容体の刺激を介して単球の機能を制御しているため、メトトレキサートは他の細胞からのアデノシン放出を促進することにより、単球に間接的に影響を与える可能性がある。
●ヒト末梢血単球におけるアデノシン受容体A1へのアデノシンの結合は、多核巨細胞の形成を刺激する。
●さらに、単球上のアデノシン受容体A2aやA3へのアデノシンの結合は、TNFおよびIL-6の合成および放出を阻害し、炎症性M1単球から抗炎症性M2単球への移行を促進する。
メトトレキサートの毒性
●メトトレキサートの低用量を長期投与することによって起こる毒性作用の多くは、メトトレキサートの抗葉酸に起因していることは明らかである。
●これらの毒性作用には、末梢血白血球数の減少、口内炎、脱毛が含まれ、おそらくメトトレキサートが媒介する細胞増殖の阻害に起因する。
●これらの毒性作用の多くは、メトトレキサートと葉酸が細胞内への取り込みのために同じトランスポーターを競合するため、葉酸またはフォリン酸の併用投与(メトトレキサート投与日を除く)によって防ぐことができる。
●対照的に、メトトレキサートの毒性作用の多くは、おそらくメトトレキサートが媒介するアデノシン遊離に起因するものと考えられる。
●これらのアデノシン関連の毒性作用の中には、メトトレキサート投与当日に多くの患者が経験する疲労感(アデノシンは脳内で放出され、中枢神経系のアデノシン受容体と結合して睡眠を促進する)(PMID=8330191/7648513/8874980)、リウマチ結節(PMID=9214432)、肝線維症(PMID=16783407/17872970)などがある。
治療的意味合い
●メトトレキサートは、関節リウマチやその他のリウマチ性疾患の治療に最も一般的に使用されている薬物である。
●経口投与されたメトトレキサートのバイオアベイラビリティーは限られているため、多くの患者は、メトトレキサートを非経口的に投与するか、1日に1回の経口投与ではなく、1日の間に薬剤を分割して投与することで、より良い反応を得ることができると考えられている。
●葉酸の投与が治療効果に影響を与えることなく、メトトレキサート療法に関連する毒性作用の多くを防ぐことができることが実証されているため、ほとんどの臨床医がメトトレキサートと一緒に葉酸を処方するようになり、メトトレキサート関連の副作用の有病率が減少したという結果が出ている(PMID=7978695/2405864/8484704/9041955)。
●現在、炎症性関節炎のほぼすべての患者には、禁忌薬がない場合にはまずメトトレキサートが投与され、患者が反応しない場合には別の治療法、通常はメトトレキサートとの併用療法が処方されている。
●すべての患者がメトトレキサートに反応するわけではないので、どの患者が反応する可能性が高いかを予測することができれば、より効果的に患者に適切な治療法を処方して疾患活動性を低下させ、毒性のある可能性のある薬剤への不必要な曝露を減らすことができるようになる。
●本レビューで述べたいくつかを含め、メトトレキサート反応の遺伝的マーカー(TNFAIP3)を特定することに大きな期待が寄せられていたが、現在までのところ、予測可能な因子やバイオマーカーとして明確に検証されたものはない。
●候補遺伝子研究とゲノムワイドな関連研究の両方で、メトトレキサートに対する良好な反応に関連する様々な潜在的な遺伝子変異が同定されているが、これらの関連性は他の集団で試験した場合には再現可能ではないようである。
●最近では、関節リウマチ患者の全血のトランスクリプトームデータを機械学習解析した結果、多くの炎症経路に関与する遺伝子(特にI型インターフェロンに対する反応に関与する遺伝子)の発現がメトトレキサート反応の潜在的な予測値となることが示された。
●他の研究では、メトトレキサートの反応を予測するのに有用な臨床マーカーや検査マーカーの定義を試みている(以下の表)が、同定されたマーカーは様々な研究で一定ではないようである、おそらくエンドポイントが異なるためであると考えられる。

まとめ
●メトトレキサートの作用機序には以下が含まれる
①ATICの阻害
→炎症、免疫機能を抑制するアデノシン放出増加を介して炎症反応を抑制する
②DHFRの阻害
→プリン、ピリミジン合成低下
③DHFRの阻害を介したJNKの活性化、BH2からBH4への還元の減少
→T細胞のアポトーシスに対する感受性増加
④LncRNAであるlincRNA-p21 の発現増加
→LincRNA-p21は様々な炎症プロセスの直接的、間接的調整作用を持つ
⑤NF-κB、JAK-STATシグナル経路の直接的阻害、アデノシンを介した間接的阻害
※上で葉酸と拮抗するものは赤でそれ以外は青で示しました。全ての作用が葉酸で抑制されるわけではない事は重要で、例えばアデノシン放出による抗炎症作用は葉酸を服用していても有効であるため、副作用が心配な患者では積極的に葉酸製剤を使用したいですね。
●メトトレキサートは、細胞特異的なシグナル伝達経路を調節することにより、T細胞、マクロファージ、内皮細胞、線維芽細胞様滑膜細胞など、関節リウマチの病因に関与する主要な細胞系統の重要な炎症誘発性を阻害する。
→例えばT細胞:アポトーシスに対する感受性の増加およびNF-κB活性の阻害
アデノシンの分泌を介したTreg細胞によるT細胞活性の抑制
【参考文献】
Bruce N Cronstein, et al. Nat Rev Rheumatol. 2020 Mar; 16 (3): 145-154. ”Methotrexate and its mechanisms of action in inflammatory arthritis” PMID=32066940