DPP4阻害薬は自己免疫疾患のリスクを下げる
DPP4阻害薬がRS3PEや関節リウマチなどが発症する、などという症例報告、ケースシリーズは探せばいっぱい出てきます。ただ、それが本当なのか、未だに分かりません。
今回は『DPP4阻害薬使用により自己免疫疾患の発生リスクが上がるのか』を研究した大規模な後ろ向きコホート研究をご紹介致します。
今まで欧米からの大規模コホートがいくつかありましたが、今回のものは、同じアジア圏である台湾からの報告です。
Backgrounds
●DPP4はジペプチジルペプチダーゼ-4の略語でCD26としても知られる。
●DPP4はプロリルオリゴペプチダーゼファミリーに属する膜貫通II型糖蛋白質で線維芽細胞、内皮細胞、上皮細胞、マクロファージ、Tリンパ球など、様々な細胞に発現する(PMID=12892317)。
●幅広く分布するため、免疫細胞の走化性、シグナル伝達、T細胞媒介性免疫応答、リンホカイン合成など様々な生理学的プロセスに関与すると考えられている(PMID=16277701/17098089/21404914)。
●DPP4阻害薬はグルカゴン様ペプチド-1(GLP-1)、グルコース依存性インスリン分泌刺激ポリペプチド(GIP)を増加させることにより、血糖値を下げる。
●しかし、使用により、RS3PE(PMID=22275459)、関節炎(PMID=23462883)などの発症などのいくつかの報告がある。
●今回はDPP4阻害薬と自己免疫疾患の関連について調査した。
Patients & Methods
●台湾の人口の96%をカバーする国民健康保険システム(NHI)のデータベースを使用。
●2009年1月1日から2013年12月31日までに登録された20歳以上の糖尿病患者からデータを抽出。
●参加者をDPP4阻害薬使用群と非使用群に分けた。
●除外基準
-1月糖尿病
-20歳未満または80歳異常
-登録前に後天性免疫不全症候群または悪性腫瘍と診断された方
-インクレチンベースの薬剤を使用していた方
Results
Patients characteristics
●2009年1月1日から2013年12月31日までの間に2型糖尿病と診断されたのは2163659人。
●除外基準を適応した後、2型糖尿病1959039人が対象となった。
●DPP4阻害薬使用群、非使用群でマッチングを行ったあと、両群に387099人の患者が組み込まれた。
●以下に背景を示す。

※ここで示されているSMDは標準化平均値差(Standardized Mean Difference)という指標で、簡単に言うと『0』であれば両群に差がなく、『<0』では実験群、ここではDPP4阻害薬使用群で非使用群よりも平均値が低く、『>0』であれば、DPP4阻害薬使用群で非使用群よりも平均値が高い事を意味します。
結果的にほとんどの項目が限りなく『0』に近い値であり、両群で差がない事が分かります。
自己免疫疾患発生リスク解析

上記は累積発生率曲線ですが、これを見ると、自己免疫疾患全体、関節リウマチ、乾癬、強直性脊椎炎はDPP4阻害薬を使用する群で発生率が低い事が言えます。
その他の疾患についてもハザード比が示されています。

SLEやシェーグレン症候群でもDPP4阻害薬使用群で発生リスクが低い事が分かります。
なお、この表は年齢、性別、2型糖尿病診断期間、併存疾患(高血圧症、脂質異常症、虚血性心疾患、慢性閉塞性肺疾患、慢性腎臓病、肝硬変)を含む交絡因子について調整されています。
感染症発生リスク解析
DPP4阻害薬使用群と非使用群で2型糖尿病患者の感染症の発生について、ハザード比を解析したところ、DPP4阻害薬使用群で感染症の発生率の低下が見られました(調整HR 0.45 95%CI 0.44~0.46, P<0.001)。
調整因子は、年齢、性別、2型糖尿病の診断期間、併存疾患(高血圧症、脂質異常症、虚血性心疾患、慢性閉塞性肺疾患、慢性腎臓病、肝硬変)、薬剤(経口血糖降下薬、インスリン、ステロイド、スタチン)。
自己免疫疾患発生リスクのサブグループ解析

DPP4阻害薬使用群と非使用群で、上記の項目についてサブグループ解析を行ったところ、若年患者(20~40歳代:HR 0.47、95%CI 0.35-0.61、41~60歳:HR 0.50、95%CI 0.46-0.55、61~80歳:HR 0.63、95%CI 0.58–0.68, P=0.0004)と若年ほど、自己免疫疾患の発生リスクが低い事が分かりました。
またその他にも、糖尿病の罹病期間が短いほど(2型糖尿病罹病期間0~5年:HR 0.48、95%CI 0.44-0.52; 6~10年:HR 0.48、95%CI 0.43-0.53 ; ≧10年:HR 0.86、95%CI 0.78–0.96、P<0.0001)、自己免疫疾患のの発生リスクが低い事が分かりました。
さらに、チアゾリジンジオンの使用歴のない患者はDPP4阻害薬使用群で自己免疫疾患の発生リスクがより減少していました(HR 0.55、95%CI 0.52–0.59 vs. HR 0.69、95%CI 0.58–0.81、P=0.015)。
年齢(20~60歳 vs 60歳以上)、糖尿病の罹病期間(0~10年 vs 10年以上)で再度サブグループ化した後も、DPP4阻害薬使用群の自己免疫疾患の発生率の低下が見られました。

異なるタイプのDPP4阻害薬間での自己免疫疾患の発生率の比較
次にシタグリプチン(ジャヌビア、グラクティブ)、ビルダグリプチン(エクア)、サキサグリプチン(オングリザ)、リナグリプチン(トラゼンタ)を含む4種類のDPP-4阻害剤間での自己免疫疾患の累積発生率を比較しています。

交絡因子を調整した後のCox回帰分析の結果、サキサグリプチン群はシタグリプチン群と比較して自己免疫疾患の発生率を22%(調整HR:0.78、95%CI:0.62-0.98)、強直性脊椎炎の発生率を46%(調整HR:0.54、95%CI:0.37-0.79)減少させたのに対し、リナグリプチン群はシタグリプチン群と比較して関節リウマチの発生率を75%(調整HR:0.25、95%CI:0.11-0.59)減少させたことが明らかになりました。※統計的に有意なもののみ言及されています。
自己免疫疾患の発生におけるDPP4阻害薬の用量依存的解析
ここでは、登録された2型糖尿病患者を5年間(2009年から2013年)追跡した時の自己免疫疾患の発生におけるDPP4阻害薬の用量依存的効果を解析しています。

DPP4阻害薬の使用日数が≤180日と>180日では、若干>180日で自己免疫疾患の発生率が低いように見えますが、統計学的に有意な差はありませんでした(P=0.192)。それにも関わらず自己免疫疾患の発生率はDPP4阻害薬使用群で非使用群よりも有意に低下していました(P<0.001)。
まとめ
●台湾において、2型糖尿病患者では、DPP4阻害薬使用群で非使用群より、自己免疫疾患(特に関節リウマチ、乾癬、強直性脊椎炎、SLE、シェーグレン症候群)の発生リスクが低い。
●サブグループ解析では、若くて糖尿病の罹病期間が短い患者ほど、自己免疫疾患の発生リスクは下がる。
●DPP4阻害薬使用群で非使用群と比較して、感染症の発生リスクも低い。
My comment
●DPP4が別名CD26であると初めて知りました。
●CD26は免疫細胞の走化性、シグナル伝達、T細胞媒介性免疫応答、リンホカイン合成など様々な生理学的プロセスに関与するようですので、それを抑えることは、免疫抑制に働く、と何となく理解はできます。
●Discussionに書かれていましたが、乾癬の皮膚のケラチノサイトとT細胞の表面で、CD26(DPP4)が発現亢進している事です。したがって、DPP4阻害薬使用によりT細胞の活性化が抑制され、血糖コントロールとは別に、乾癬の皮膚病変が改善する可能性があります(PMID=22056790)。
●DPP4阻害薬に使用で感染症の発生リスクも下がる事は興味深いです。一部のウイルスなどはDPP4を介して感染を成立させるようです(PMID=23486063)。
●なお、米国からのコホート研究(PMID=24919467)や、韓国のコホート研究(PMID=30964554)でも2同様にDPP4阻害薬使用により自己免疫疾患のリスクが低下する可能性があるとのこと。
●大規模スタディは数で押し切って有意差を出してしまう点がどうしても否めませんが、それでもDPP4阻害薬の使用は少なくとも自己免疫疾患の発生リスクはあげないことはわかります。
●じゃあ”DPP4阻害薬使用により、RS3PEを発生した~””DPP4阻害薬使用により関節リウマチが発症した~”という報告は一体何なのでしょう。完全に否定せずに、慎重に考えていく必要があります。
【参考文献】
Yi-Chuan Chen, et al. Acta Diabetol . 2020 Oct; 57 (10): 1181-1192. "Dipeptidyl peptidase-4 inhibitors and the risks of autoimmune diseases in type 2 diabetes mellitus patients in Taiwan: a nationwide population-based cohort study" PMID=32318876
なぜ、IL-17阻害薬は腸炎を悪化させるか?
主に脊椎関節炎に使用されるIL-17阻害薬ですが、炎症性腸疾患を発生させるという報告が散見されます。
その相反する作用を理解するには、IL-17の関節に対する機能と、腸管に対する機能を理解する必要があります。
本日は、IL-17の役割とその阻害薬による炎症性腸疾患の発症についてまとめたいと思います。
- IL-17とは
- IL-17と自己免疫疾患
- IL-17抑制による腸炎悪化の機序の仮説
- IL-17阻害薬の臨床試験
- IL-17阻害薬による腸炎のReal World Evidence
- IL-17阻害薬を使用する際のPractice
IL-17とは
Figure 1: IL-17の分子学的な側面

IL-17は、IL-17AからIL-17Fの6つのサブタイプに分かれており、それぞれ少しずつ役割が異なります(Figure 1C)。この中で、炎症の惹起と、腸管での微生物に対する防御に関与するのはIL-17A、IL-17C、IL-17Fです(他のサブタイプも炎症性サイトカイン分泌を誘導する可能性が言われています)。
IL-17は様々な細胞から分泌されるサイトカインですが、主にはTh17細胞から分泌されます(Figure 1A)。
IL-17を主に分泌するTh17細胞は腸管(特に小腸)の粘膜固有層に多数存在しており、平常時はIL-22などを介して抗菌ペプチドの産生を促進して、腸内細菌や真菌などに対する防御(バリア機構)を担っております。
腸内細菌のバランスが不均衡(dysbiosis)、つまりは菌量が増えたり、菌叢が変化したりすると、防御するためのTh17が活性化し、それが行き過ぎると自己免疫疾患を引き起こすと言われています。特に関節炎を引き起こす事は有名です(Figure 1B)。もちろん、炎症を起こすので炎症性腸疾患の病態にも関与していると知られています。
IL-17と自己免疫疾患
具体的にTh17の関与が言われているのは、多発性硬化症、炎症性腸疾患、乾癬(乾癬性関節炎)など、多数の疾患です(PMID=25152827)。
しかし、腸内細菌のバランスが不均衡(dysbiosis)だけで関節炎が起こるというわけではなく、遺伝的な素質がある方(HLA class I)が環境因子(腸内細菌のDysbiosis)に曝露されて初めて自己免疫介在性の炎症が起こると考えられています(Figure 2)。
Figure 2: 腸管-関節軸
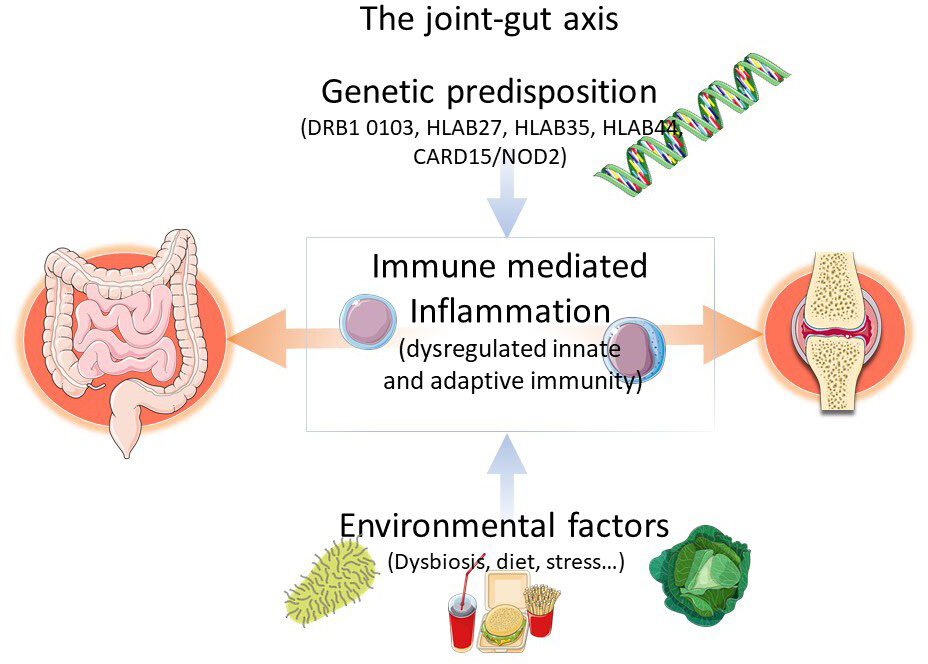
さて、Th17が活性化に伴うIL-17産生が亢進すると、自己免疫が活性化し、乾癬、関節炎さらには腸炎が悪化するため、IL-17阻害薬を使用すると、それらが改善すると考えられていますが、実際の所は、乾癬や関節炎は改善しますが、腸炎に関しては、逆に悪化する報告が散見されます。
一体なぜでしょうか?
IL-17抑制による腸炎悪化の機序の仮説
詳細な機序についてはまだまだ研究が必要ですが、
機序の一つとして考えられているのは、腸管でのバリア機構がIL-17阻害薬によって抑制される事です。
マウスの腸炎モデルでは抗IL-17抗体を投与する事で腸炎の悪化が確認されましたが、TNF-α、IFN-γ、IL-1βやIL-6など、他の炎症性サイトカインの発現亢進が見られました(PMID=14962796)。抗菌薬投与により、Th17細胞が減少する事(PMID=18716618)、糸状菌の投与でTh17細胞が誘導された事(PMID=19836068)より、IL-17を阻害する事でTh17
による粘膜のバリア機構が抑制され、腸内細菌が腸管壁に侵入し、炎症を引き起こした可能性が示唆されました。
また、別の経路の炎症細胞が活性化する可能性も示唆されています。
IL-17を欠損したマウスではTh1に関連した遺伝子発現が亢進しており、Il-17がブロックされたとき、Th1経路が腸炎を悪化させる可能性が示唆されております(PMID=19448631)。
IL-17阻害薬の臨床試験
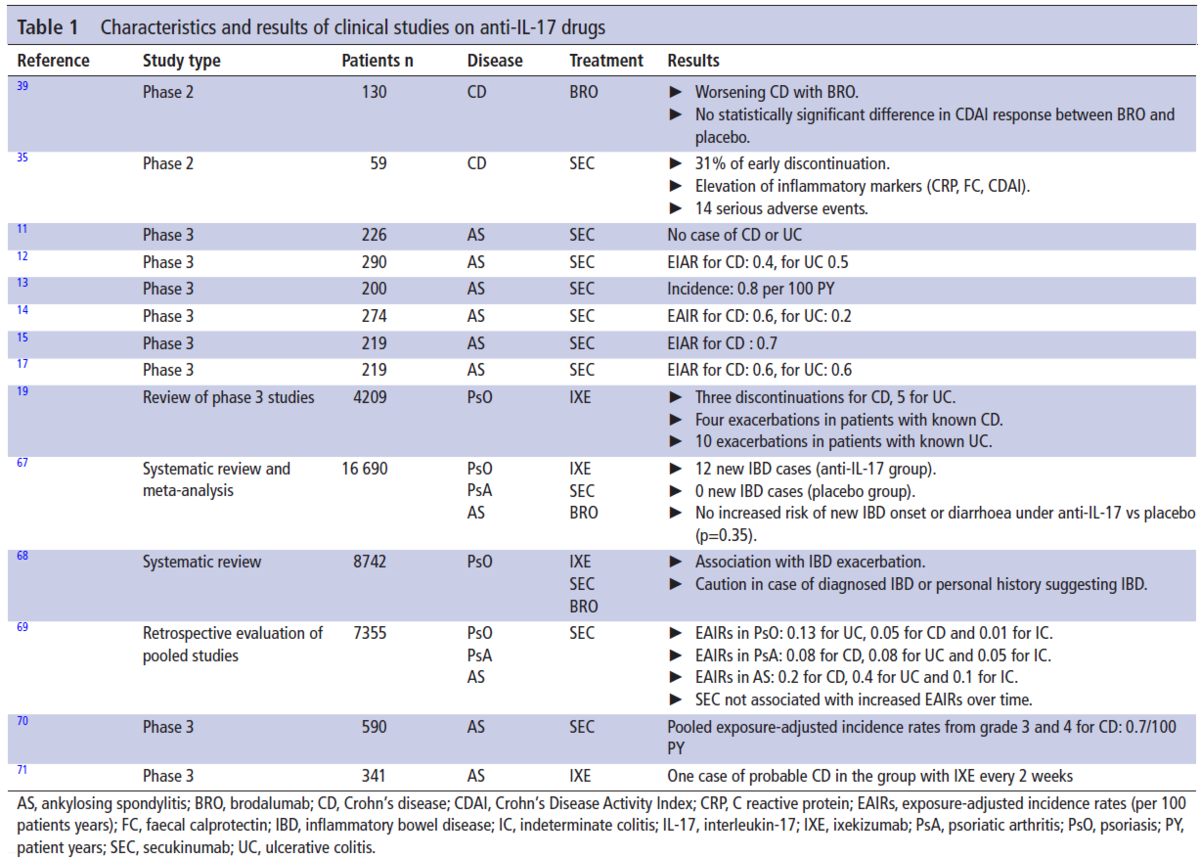
上記にIL-17阻害薬の臨床試験を示します。
潰瘍性大腸炎やクローン病の発生頻度やリスクがまとめられていますが、おおざっぱに言うと、IL-17阻害薬を使用した時に、潰瘍性大腸炎やクローン病の発生率は1000人年あたり2.4人だそうです。
この数字は多いか少ないか、というと、決して多くはないですが、無視できる数字ではないと思います。
IL-17阻害薬による腸炎のReal World Evidence
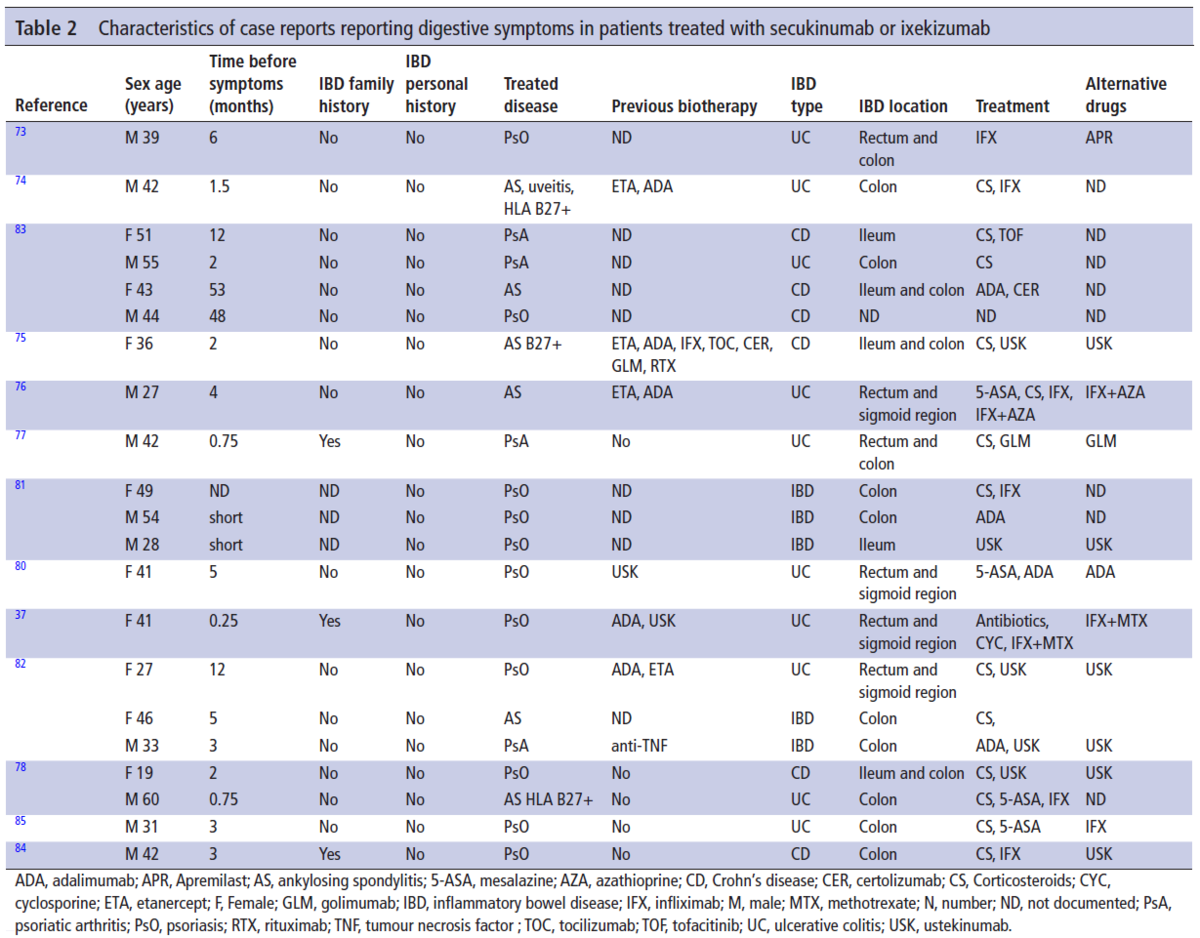
Secukinumab開始後に新規に炎症性腸疾患が発症した症例は、全部で19例報告されています。全員乾癬の既往がない患者ですが、3人は家族歴があります。
多くは乾癬や乾癬性関節炎に対してSecukinumabが使われていますが、消化器症状が出現するまでの平均期間は12.8か月とのことです。小腸が多いかと思いましたが、意外と大腸病変が多いようです。
患者さんは代替薬としてコルチコステロイドやTNFα阻害薬が使用されましたが、Secukinumabを中止された後、症状は改善しています。
IL-17阻害薬を使用する際のPractice
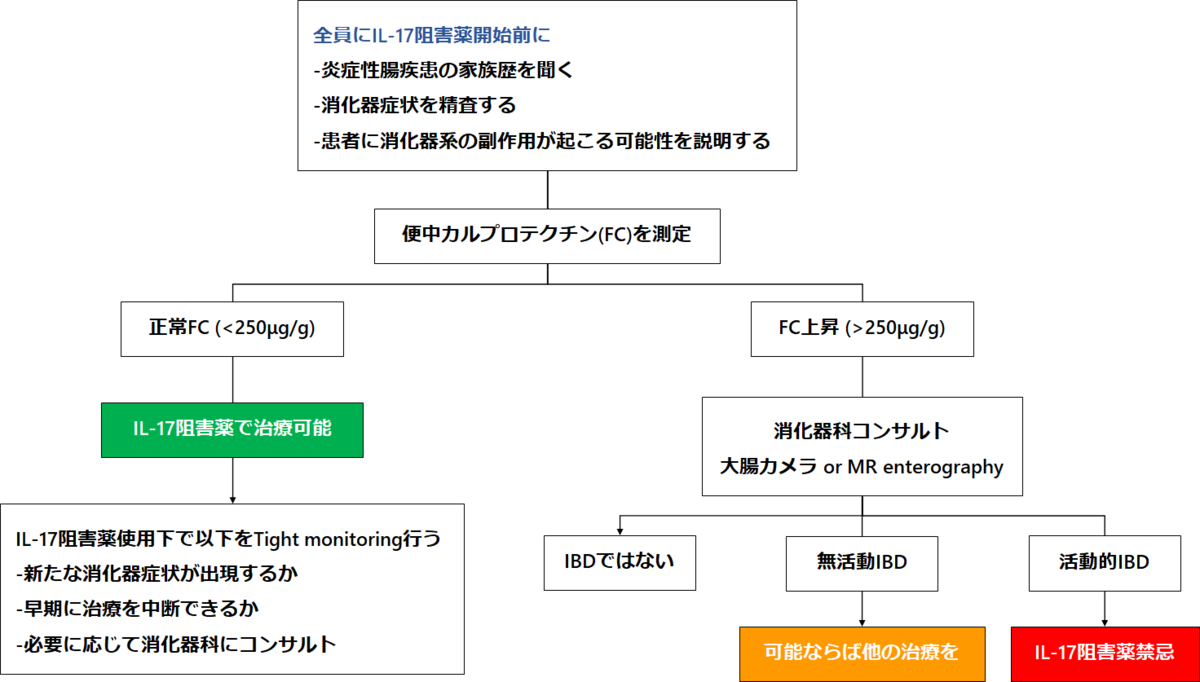
IL-17阻害薬を使用する際には、僅かながら炎症性腸疾患の発症リスクがある事をお伝えしましたが、実際にIL-17阻害薬を開始前に上記のようなマネジメントしていく事が提唱されています。
便中カルプロテクチンは炎症性腸疾患において、"腸版CRP"のようなものです。日本でも『潰瘍性大腸炎の病態把握の補助』、FEIA法で測定した場合は『慢性的な炎症性腸疾患(潰瘍性大腸炎やクローン病等)の診断補助』で保険適応となっています。
【参考文献】
Marine Fauny, et al. Ann Rheum Dis . 2020 Sep; 79 (9): 1132-1138. "Paradoxical gastrointestinal effects of interleukin-17 blockers" PMID=32719044
強皮症エキスパート達の治療選択2018
強皮症は様々な臓器に多彩な病変を生じるため、どうしても全ての病態を対象とした治療が研究しづらい疾患となっています。多彩な症状に対してはそれぞれの臨床医が各々薬剤を使い分けているのが現状であると思います。
そんな中で2018年、ガイドラインではありませんが、強皮症のエキスパートらが各病態に対してどのような治療を行っているか、投票をもとに治療のコンセンサスアルゴリズムが作られました。
全ての病態に対して言及されており、ガイドラインよりも、生の声が聞ける点では、かなり有用ではないかと思います。
こちらもご覧ください。
専門家たちの背景
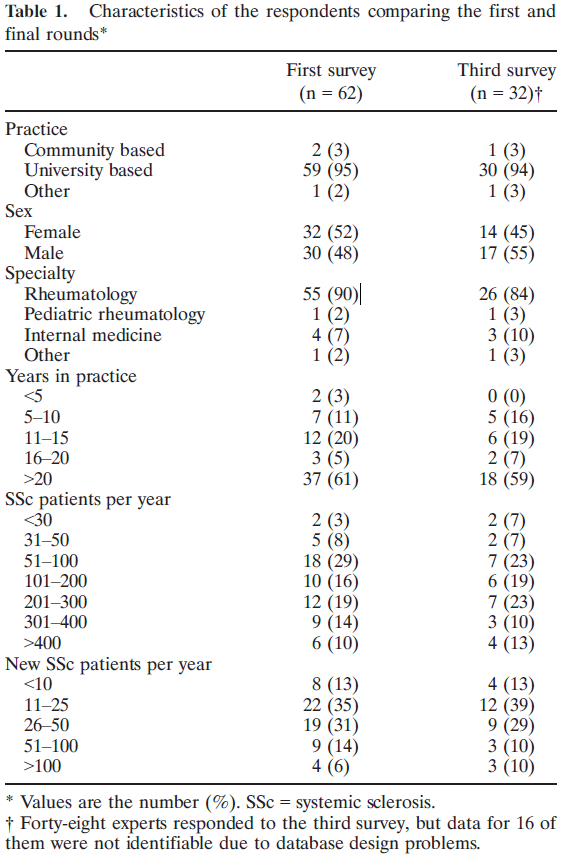
→10年目以降の医師が多く、中堅以上であるとわかります。
→診察している強皮症患者は年間100人以上、新規患者が10人以上の割合が多く、かなり専門家であるとわかります。私はせいぜい年間10-20人、新規患者2-3人です。
→ちなみに出身国はアメリカが27人、ヨーロッパが17人とやや偏りがあります。日本人で強皮症のエキスパートと言えば、日本医科大学の桑名先生でしょうか。
腎クリーゼの治療

●降圧の目標
-140/80mmHg以下:39%
-120/80mmHg以下:37%
-150/90mmHgよりも高い:9.3%
●目標血圧に到達するまでの時間
-24時間以内:15%
-24-48時間:44%
-48時間から1週間:33%
-1週間以上:7%
●半分(36/62)のエキスパートは妊娠患者ではACE阻害薬を処方しない結果であった。
●Ca拮抗薬はニフェジピンが最も良く使われ、30mgを1日1回(37%)、10mgを1日3回(30%)などの用量で使用されることが多かった。30mg1日2回、20mg1日3回とする専門家はそれぞれ11%、22%でった。
→以下の記事も参考にして頂きたいのですが、強皮症腎クリーゼの降圧目標は定義同様、実はあまり決まっていなく、専門家の中でも意見が割れている事がわかります。
炎症性関節炎の治療

●ステロイドは75%、NSAIDsは77%の専門家が処方している。
●ステロイドの使用量
-7.5mg/日未満:54%
-7.5-20mg/日:41%
●ステロイドの使用期間
-3か月以内:67%
-3-6か月:8%
-6か月以上:25%
→関節リウマチに準じた治療が多いようです。ただしMTXは間質性肺炎がある場合は使いにくいかもしれません。海外ではヒドロキシクロロキンが関節リウマチに適応がありますが、日本では適応がありません。
皮膚硬化の治療
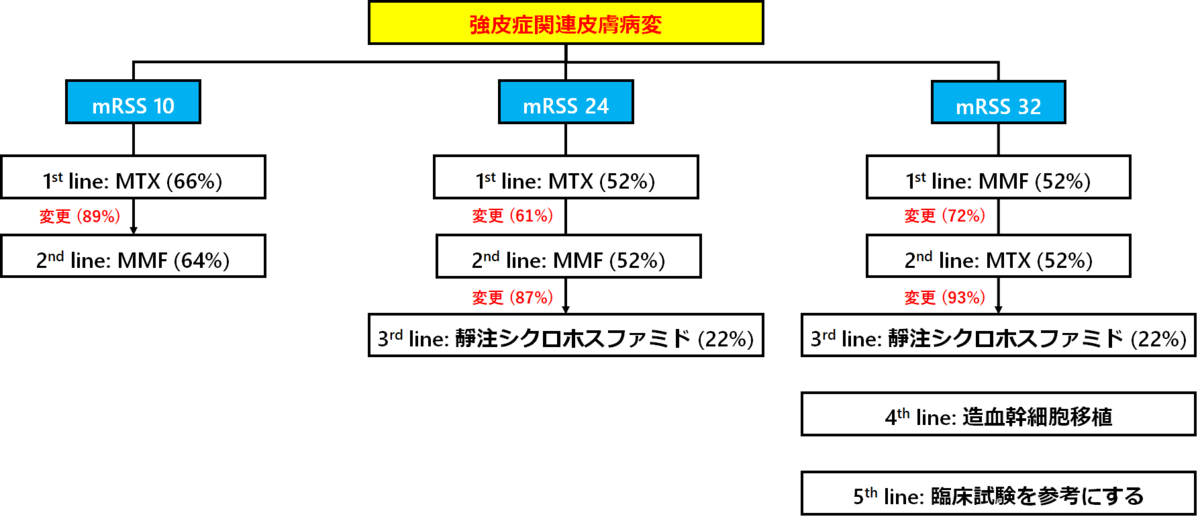
※mRSS: modified Rodonan skin thickness score
→皮膚硬化に対する免疫抑制薬についてはMTXかMMFか意見が均衡しています。特にmRSS 24点の時、1stはMTXで専門家の52%が同意していますが、残りの48%はMMFを選んでいました。間質性肺炎を考慮すると、MMFが良い選択肢と言えそうです。
→ステロイドについては少数ながら使用している専門家もいるようです。
●ステロイドの使用頻度
-いつも:13%
-時々:19%
-ごくたまに:33%
-なし:35%
●ステロイドの使用量
-7.5mg/日未満:49%
-7.5-20mg/日:51%
なお、2020年にヨーロッパから発表されたEBMに基づくコンセンサスステイトメントではステロイドの単独使用は推奨されておりません(Lancet rheumatol 2020; 2: e71-e83)。
間質性肺炎の治療
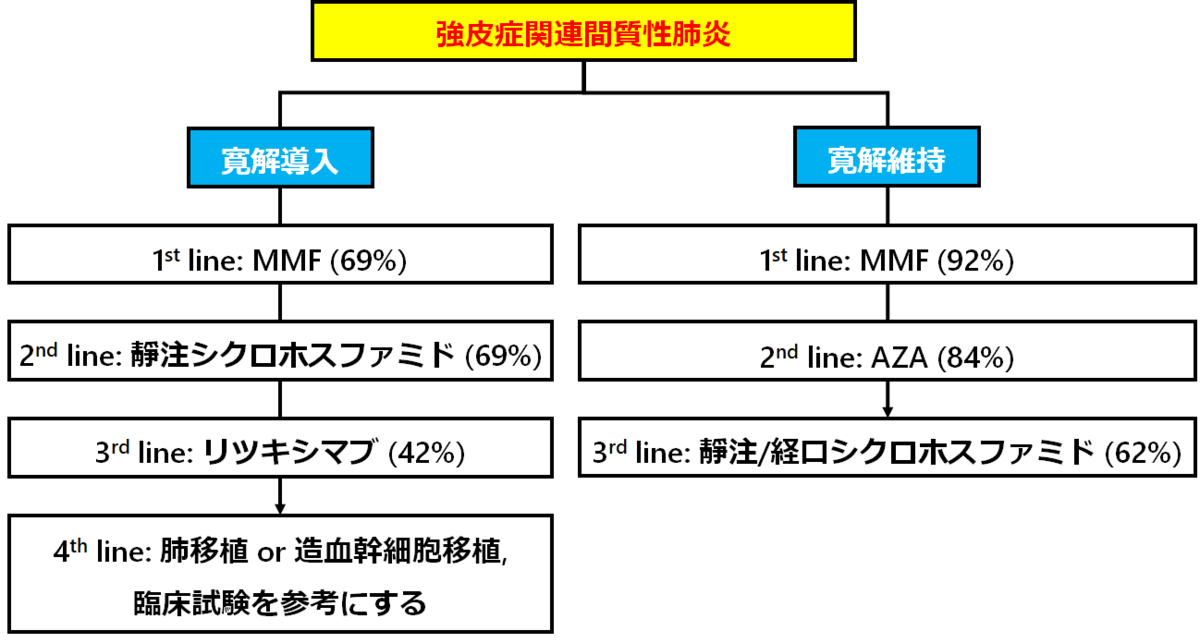
→MMFは強皮症に保険適応が通っておらず、日本の強皮症診療ガイドライン2016では推奨度が2Cですが、海外では好まれます。私も好きです。
→この論文は、強皮症関連間質性肺炎の治療として抗線維化薬であるニンテタニブがまだ承認されていない時期のものですので、抗線維化薬を推奨する専門家はいませんが、2020年のヨーロッパからのコンセンサスステイトメントでは100%の専門家がニンテタニブを強皮症関連間質性肺炎に使用することに同意しています(Lancet rheumatol 2020; 2: e71-e83)。またMMFとの併用についても単剤で無効の際には考慮されるとしています。
→また2020年にトシリズマブによる強皮症関連間質性肺炎の進行抑制効果が臨床試験で示されました(PMID=32866440)。今後、専門家たちのコンセンサスにも反映される事でしょう。
→注目すべきは、他の膠原病関連間質性肺炎と異なり、強皮症ではステロイドが使われない事です。専門家の中でも"いつも使用している”が11%、”時々”が28%、”ごくたまに”が24%、37%が”使用しない”でした。ステロイドを使用する場合、PSL<7.5mg/日が41%、7.5-20mg/日が46%、>20mg/日が13%でした。使用する期間も3か月以内が42%、3-6か月が33%、6か月以上が8%と比較的短期間でした。
肺高血圧症の治療

※ERA: エンドセリン受容体拮抗薬、PDE5i: PDE5阻害薬
●Mildの場合、PDE5阻害薬がエンドセリン受容体拮抗薬よりも好まれる。
●23%のエキスパートは両者の併用を好む。
●重症では1stとしてプロスタノイドが最多だが、27%の専門家はPDEi+ERAを好んだ。
●経口抗凝固薬の併用頻度
-いつも:6%
-時々:28%
-ほとんどない:30%
-なし:37%
●使用される場合の抗凝固薬の種類
-ワーファリン:60%
-DOAC:7%
-いずれか:31%
レイノー症候群の治療

※追加でアスピリン(75%)、スタチン(29%)、ペントキシフィリン(7%)、フルオキセチン、亜硝酸薬外用(54%)などが用いられる事もある。
→中等度のレイノー症候群の治療について触れていないのが惜しいです。
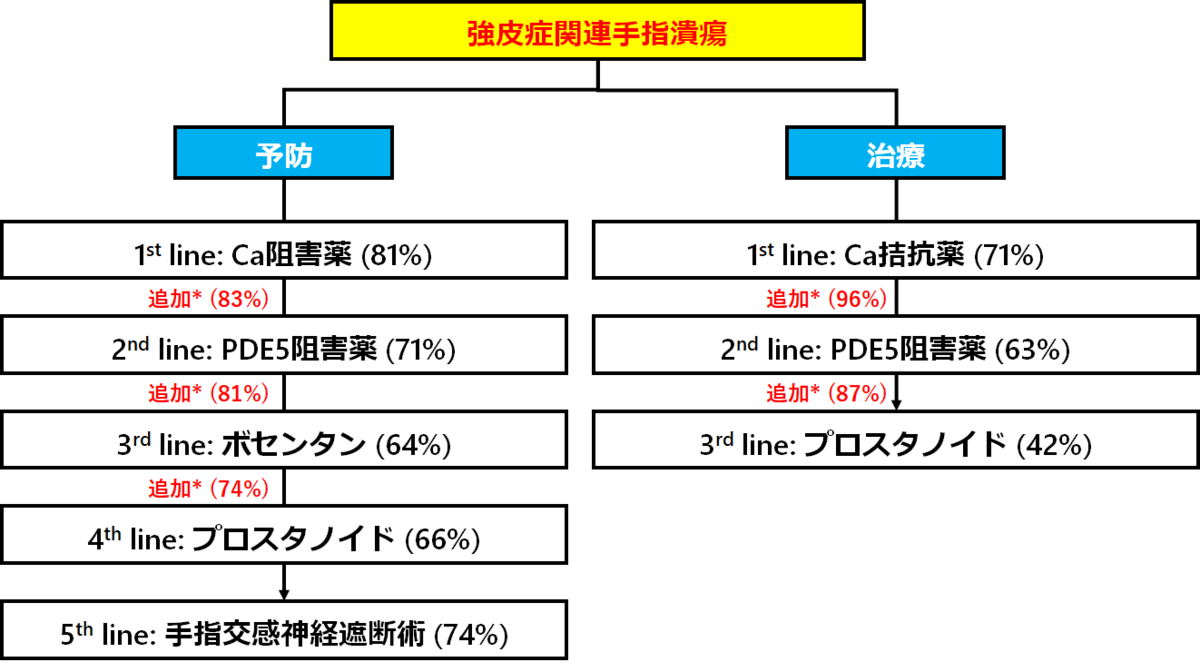
手指潰瘍の治療
胃腸病変の治療
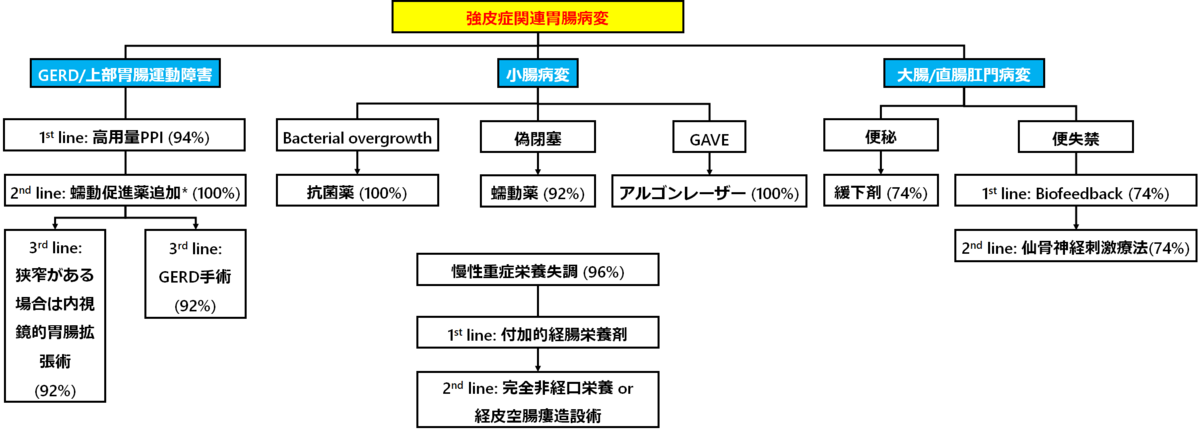
●腸管蠕動薬の種類
-メトクロプラミド:44%
-ドンペリドン:31%
-エリスロマイシン:15%
-オクトレオチド:15%
●抗菌薬の種類
-メトロニダゾール:60%
-シプロフロキサシン:60%
-リファキシミン:35%
-ドキシサイクリン:23%
心病変の治療
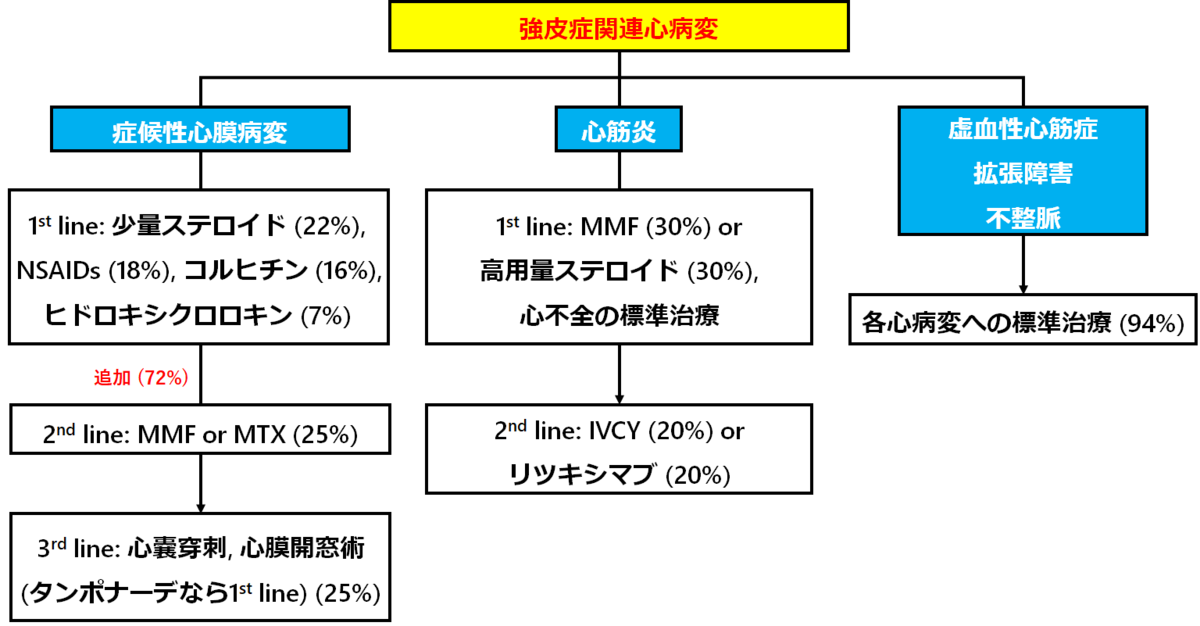
【参考文献】
Andreu Fernández-Codina, et al. Arthritis Rheumatol. 2018 Nov; 70 (11): 1820-1828. "Treatment Algorithms for Systemic Sclerosis According to Experts" PMID=29781586
【Review】免疫不全患者の重症呼吸器感染症
近年、免疫不全状態にある重症患者の割合はICU入院全体の約3分の1を占めるまで増加しているようです。
殊に昨今では新型コロナウイルス感染症の流行があり、重度呼吸器感染症においてはより鑑別が重要になってきていると思います。
今回は免疫不全患者における重症呼吸器感染症に特化したReviewをまとめます。
さて、一口に免疫不全と言っても、その程度には様々あります。
以前に免疫不全の重症度にまとめましたのでご参照ください。
※※※※※※この論文では以下の患者を免疫不全患者と定義しています※※※※※※
●長期(>3か月)または高用量(>0.5mg/kg/日)のステロイド、他の免疫抑制薬の使用
●固形臓器移植レシピエント
●過去5年間に化学療法を必要とする固形癌の患者
●診断から治療を受けた後の血液悪性腫瘍
●一次免疫不全患者
※リウマチ膠原病領域の免疫抑制の程度と比べると、より重度と言えます。
※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※
それではまず、一般的な考慮事項から進めて行きます。
免疫不全患者の急性呼吸不全診断に関する一般事項
●免疫不全患者において、急性の低酸素性の呼吸不全では原因微生物を特定することは必要不可欠です。
●原因を特定できないと、死亡リスクが高くなると言われています(PMID=27783381)。
●一部の患者では複数の病原微生物が同時感染する事があり、さらには感染症に似た非感染症が急性呼吸不全の原因となる場合もあります。
●急性呼吸不全を起こす非感染症は、今回のReviewでは取り上げていませんが、放射線性肺障害、薬剤関連肺障害、びまん性肺胞出血、肺水腫、基礎疾患による肺障害(白血病肺障害、生着症候群、GVHD、リンパ管癌腫症、肺血管炎など)などが挙げられます。
●気管支鏡検査や気管支肺胞洗浄は一般的に診断に使用されますが、低酸素血症の患者ではさらに呼吸状態を悪化させる可能性があるため(PMID=31109985)、他の血液検査、尿検査、痰検査、鼻腔スワブ検査などで代用できるのであれば、回避すべきです。
●以下に免疫不全患者における急性呼吸不全の診断に関して、一般的に考慮すべき10の事項を挙げます。

●既存のガイドラインでは診断に有効な検体を採取する重要性が強調されています(PMID=24833776)。
●ただし多くの場合、抗菌薬は検体が採取される前にすぐに開始されてしまうため、結果として原因となる病原体は、細菌性肺炎の場合、約半数にしか確認されません。
●その代わりに臨床症状や検査所見、放射線画像所見などによる詳細な分析が診断の方向性の鍵を握ります。
臨床評価のためのDIRECTアプローチ
●病因評価の最初のステップは臨床評価です。そのためのDIRECTアプローチというものを以下に示します。

※正直、このアプローチをどうやって使うのか意味が分かりませんが、『免疫不全患者の急性呼吸不全では症状が起こるまでの日数や免疫不全状態を意識して、胸部X線でスクリーニングし、経験のあるスタッフにも意見を聞いて、ショックなどの臨床像に注意し、積極的にCTを取りに行こう』という解釈でしょうか…広めたいのなら、ちゃんと解説を付けるべきだと思います。CT所見による鑑別に関しては下記をご覧ください。
●いずれにせよ、臨床評価の段階で可能性のある病因を2,3個に絞り、必要に応じて侵襲的・非侵襲的検査を行う必要があるということです。
●免疫不全の種類と罹患しやすい感染症については下記をご覧ください。
●気管支鏡・気管支肺胞洗浄の適応は10の考慮事項の9番目にも書いてある通り、その診断確率が高い状況(臓器移植、HIV感染、全身性炎症性関節疾患、ニューモシスチス肺炎の可能性が高い場合、びまん性のすりガラス陰影)では推奨されますが、他の状況(悪性腫瘍、単なる好中球減少症、浸潤影、または気管支/細気管支疾患などの患者)では推奨されません。
●また気管支鏡・気管支肺胞洗浄を行う際にはネーザルハイフローなどの高流量酸素を投与すべきとのことです。
●今後、微生物のRNA-Seq解析やプロテオーム(蛋白)解析が主流になれば、気管支鏡・気管支肺胞洗浄は不要になるかもしれません。
免疫不全と肺感染症

※原発性免疫不全症でない限り、一系統のみ免疫細胞がやられるということはあまりありませんが、図がきれいなので参考にはなります。
CT所見による肺感染症の鑑別

※この図は綺麗だなと素直に思いました。外人はこういうのを作成するのが上手です。
続いて、各々の病原微生物毎の特徴を示します。
各病原微生物毎の肺炎の特徴
細菌性肺炎
リスク
●細菌性肺炎は癌患者のICU入院の約30%というデータがあります(PMID=28948369)。
●発生率は免疫抑制の程度に寄ります。
-肺癌の化学療法後:5%(PMID=18466999)
-急性白血病の寛解導入後:30%(PMID=23987587)
-肺移植後:30%(PMID=17617864)
-腎移植後:5%(PMID=14769736)
●脾摘は、特に莢膜を持つ細菌(肺炎球菌、インフルエンザ桿菌、髄膜炎菌)による肺炎の発症リスクが高いため、ワクチン接種が適応となります。
●あらゆる免疫抑制が細菌性肺炎のリスクとなります。市中肺炎で入院した患者の5人に1人は免疫不全というデータがあります(PMID=31222287)。
●ステロイドはプレドニゾン換算で10mg/日以上を3か月以上で免疫抑制の原因となります。
●好中球減少症では好中球数100/μl未満が、7日以上持続する場合は細菌性肺炎のリスクが高くなります。重篤な肺炎を伴う重症の癌患者の約10%が好中球減少症を持っています(PMID=25803690)。
●リンパ球減少症も肺炎リスクの上昇と関連しています(PMID=30383787)。
●体液性免疫不全や低ガンマグロブリン血症は、肺炎球菌やインフルエンザ桿菌による肺炎のリスクです(PMID=24582312)。
●その他、COPDや気管支拡張症などの肺の構造異常や糖尿病、喫煙、アルコール多飲も細菌性肺炎や緑膿菌肺炎のリスクとなります。
●ノカルジア症では血液腫瘍や固形癌、高用量ステロイド療法、TNFα阻害薬がリスクとなっています(PMID=26074688)。
●髄膜炎菌感染症のリスクは鼻咽頭保菌者、補体欠損です(PMID=10028078)。
●ロドコッカス(放線菌)肺炎は造血幹細胞移植や固形臓器の移植レシピエントで報告されています(PMID=28221102)。
●レジオネラは癌患者だけでなく、全身性コルチコイドステロイド、生物学的製剤を受けている患者でも報告されています。
症状
●細菌性肺炎は、非特異的な症状(例えば、咳、呼吸困難、発熱、喀痰分泌、胸膜性疼痛)や肺浸潤影を呈する患者では考慮すべきです。
●しかし免疫不全患者では症状はしばしば不明瞭になります(PMID=1052668)。
●肺外症状はレジオネラやノカルジアの感染を示唆します。ノカルジアでは血流、皮膚、骨、関節、網膜、心臓、中枢神経系に伝播する可能性があります。
微生物
●細菌性肺炎では肺炎球菌、クレブシエラ、インフルエンザ桿菌が最多の起炎菌です。
●その他、緑膿菌、腸管由来のグラム陰性菌、Stenotrophomonas属、MRSAを考慮します。
●多剤耐性菌(MDR)は免疫不全患者では有意に多くみられます。ある研究では人工呼吸器関連下気道感染症の72%がこれらの細菌に由来したといいます(PMID=29439020)。
●マイコプラズマやレジオネラ、クラミジアについてはデータが乏しいです。
検査
●非侵襲的検査として痰培養、血液培養、尿中抗原があります。
●喀痰グラム染色や痰培養は適切な採取方法と抗菌薬投与前であれば有用かもしれません。
●気管内吸引は排出喀痰よりも原因菌を回収する可能性が高く、挿管直後に採取された菌は単なるコロニーとは考えにくいです。
●急性呼吸不全の癌患者に対するランダム化比較試験では非侵襲的検査(喀痰検査を含む)のみを行った場合は、気管支鏡・気管支肺胞洗浄を行った場合に非劣勢だったといいます(PMID=20581167)。
→気管支鏡や気管支肺胞洗浄などの侵襲的検査が必ずしも必要というわけではないかもしれません。
●市中肺炎のために入院した患者において、尿中抗原の検出率は肺炎球菌で感度61%、特異度39%、レジオネラで感度63%、特異度35%だったという報告があります(PMID=30265290)。
→感度は高くないですが、想像以上に特異度が低い事に驚きます。
●血液培養の陽性率も市中肺炎で入院した患者では陽性率は5~14%と低いですが、(PMID=20581167/31573350)。肺病変が重症だと陽性率が高い事が報告されています。
→肺炎の血培陽性率が低い事は有名ですが、肺炎だと思っていたら実は別の感染症+二次性肺炎の事もあり、重症では採取する事が望ましいと考えます。
●PCRによる細菌の同定は感度が最大81%という報告があり、抗菌薬を投与された患者でも標準的な培養検査などよりも優れている可能性があります(PMID=20014950)。
●胸水培養の陽性率は約35%であり、血液培養ボトルを使用すると60%に上昇します(PMID=21459855)。
●ノカルジア症の診断には特定の培地とPCR検査が必要です。
●ロドコッカスは通常の培地で容易に増殖します。
●Q熱の診断には血清学的検査が必須です。
●リアルタイムPCR(RT-PCR)はコロニー形成と感染の区別するのに役立つ定量的な情報が得られます。耐性遺伝子の検出にも使用でき、最適な抗菌薬の使用に役立ちます(PMID=27463099)。
→感度が高く、コロニーでも増幅してしまう、と思っていましたが、むしろ量で判断するという事などでしょう。
●次世代シーケンシング(NGS)などの新しいツールは検体中の細菌、真菌、ウイルスを同定するために開発されており、併発する感染症の診断を改善する可能性があります(PMID=30237069)。
治療・予後
●初期治療は各種臨床診療ガイドラインや各施設での抗菌薬の感受性に従う必要があります。
●免疫不全患者の重症の肺炎はしばしば致命的で、癌患者の75%が敗血症性ショックになったという研究では、病院での死亡率は64.9%だといいます(PMID=25803690)。
抗酸菌性肺炎
結核のリスク
●活動性肺結核のリスクは、HIV、糖尿病、悪性腫瘍、固形臓器移植後、全身性ステロイド投与、TNFα阻害薬治療などです(PMID=27932390)。
結核の症状
●抗酸菌感染症の症状は市中肺炎の症状と比べるとより潜在的で、持続的な咳嗽、リンパ節腫大、発熱、寝汗、体重減少などがあります。
●免疫不全の患者では、肺外への病原体の播種が一般的にも関わらず(PMID=29890021)、持続的な発熱などの軽度の症状が1つしかない、またはあっても数個しか症状が出ないなどの場合があります(PMID=23351041)。
結核の診断
●結核のHRCTの所見は粟状結節、空洞形成、小葉中心性tree-in-bud結節、浸潤影、縦隔リンパ節腫大、胸水などが含まれます(PMID=26607644)。空洞形成や小葉中心性tree-in-bud結節は上葉に多く見られます。
●肺結核の診断は3回の誘発喀痰の塗抹と培養、または1回の気管支鏡で得られた検体によって行われます。培養にはLowenstein-Jensen培地が必要ですが、偽陰性が一般的です。PCR検査は最初の検体で行うべきです。
→3回の誘発喀痰がすべて陽性である必要がある、というわけではないと思います。どちらかというと3回とも陰性なら否定的というところでしょうか。PCRが最初の検体で行うべきというのはなぜでしょう。
●喀痰のPCRの感度は89%、特異度は99%であり、喀痰塗抹所見が陰性でも感度67%、特異度99%であると報告されています(PMID=27932390)。
●PCRはHIV陽性患者よりも陰性患者の方が陽性率が低く出る可能性があります。
●ADAやIFN-γは胸水で測定できるマーカーです。
●診断したら、結核薬の併用が必要です。さらに研究が必要ですが、結核と急性呼吸不全の患者の死亡率をステロイド療法が減少させる可能性を示唆した報告もあります(PMID=27609755)。
●急性呼吸不全を有する結核患者の死亡率は50~70%と報告されています(PMID=17539846)。
非定型抗酸菌症のリスク
●非結核性抗酸菌は環境中のどこにでも生息しています。
●現在までに200種が確認されています。
●人では慢性肺疾患、リンパ節炎、皮膚疾患、播種性疾患の4つの臨床症候群に分類されます。
●リスクは結核同様、HIV感染、ステロイド、TNFα阻害薬、糖尿病、悪性腫瘍、固形臓器移植などが含まれます。
非定型抗酸菌症の症状
●咳、疲労、倦怠感、倦怠感、脱力感、呼吸困難、胸部不快感、時々喀血を呈します。
●肺外では関節炎、腱鞘炎、皮膚病変、消化管症状を起こします(PMID=31077618)。
→たまに腱鞘炎でNTMだったという報告を聞きます。皮膚病変については言うまでもないですよね。
●発熱や体重減少は結核感染よりも少ないです。
●NTMは環境中に存在するため、滅菌していない喀痰検体中のNTMの存在は必ずしも原因菌となるわけではありません(PMID=17277290)。
非定型抗酸菌症の診断
●米国胸部学会(ATS)/米国感染症学会(IDSA)の診断基準では以下を満たす場合
-肺症状
-胸部X線所見
-喀痰培養2回陽性または1回の気管支肺胞洗浄液培養陽性
-肺生検で合致する組織所見
なお、日本では2007年に上記の米国胸部学会/米国感染症学会が発表したガイドラインを元に2008年に日本呼吸器学会/日本結核病学会が定めた以下の基準が用いられます。
肺NTM症の診断基準
下記臨床的基準と細菌学的基準をともに満たす場合に肺NTM症と診断する。
**********************************************************************************************
臨床的基準(以下の2項目を満たす)
-肺部画像所見(HRCTを含む)で、結節性陰影、小結節性陰影や分岐状陰影の散布、
均等性陰影、空洞性陰影、気管支または細気管支拡張所見のいずれか(複数可)を示す。
ただし、先行肺疾患による陰影がすでにある場合にはこの限りではない。
-他の疾患を除外できる。
細菌学的基準(菌種の区別なく、以下のいずれか1項目を満たす)
-2回以上の異なった喀痰検体での培養陽性(間隔を問わない)。
-1回以上の気管支洗浄液での培養陽性。
-経気管支肺生検または肺生検組織の場合には、抗酸菌症に合致する組織学的所見と
同時に組織、または気管支洗浄液、または喀痰での1回以上の培養陽性。
-まれな菌種や環境から高頻度に分離される菌種の場合には、検体種類を問わず2回以上
の培養陽性と菌種同定検査を原則とし、専門家の見解を必要とする。
-胃液を用いた抗酸菌検査の診断的意義は不明である。
**********************************************************************************************
●播種性の場合、特殊な培地で血液培養を行うべきです。
●抗酸菌培養は少なくとも6週間は行わればなりません。
●浸潤が疑われる部位の骨髄、体液、組織を培養し、特殊染色を用いた組織学的検査を行うべきです。
非定型抗酸菌症の治療
●抗菌薬の組み合わせに準じます。治療期間はNTMの種類と症状によって異なります。
ウイルス性肺炎
●一般市中感染の呼吸器ウイルス(CARV)は免疫不全患者では重篤な急性呼吸不全を起こす可能性があります。

●これにはインフルエンザウイルス、パラインフルエンザウイルス、RSウイルス、ライノウイルス/エンテロウイルス、ヒトメタニューモウイルスが含まれます。
市中感染呼吸器ウイルス(CARV)感染症の代表的ウイルス
インフルエンザウイルス
●インフルエンザの重症患者のうち、12.5%が免疫不全であり、死亡率はそうでない方の2.5倍という報告があります(PMID=30216935)。
●またインフルエンザで入院した患者のうち、10%が免疫不全患者であったという報告もあります(PMID=31298691)。
RSウイルス/パラインフルエンザウイルス
●RSウイルスもインフルエンザ同様、季節性のウイルスですが、造血幹細胞移植を受けている患者の最大で12%で発見され、その3分の1が下気道感染に進行し、約30%が致死的だったといいます(PMID=18181739)。
●パラインフルエンザウイルスはRSウイルスと同様、呼吸器疾患を起こします。
●RSウイルスとパラインフルエンザウイルスはそれぞれ、重症な血液疾患患者の鼻咽頭スワブで11%と2.5%検出されたという報告があります(PMID=30230909)。
→この論文ではウイルスの検出とICU死亡率は関連していたといいます。
●造血幹細胞移植を受けた患者を対象とした前向き研究ではパラインフルエンザウイルス3型はウイルス性呼吸器感染症の71%を占めていたといいます(PMID=29279454)。
→このウイルスはしばしば医療スタッフによって移植病棟に持ち込まれ、他の日和見感染症を模倣することがあるため、診断上、問題になる事があるようです。
ヒトメタニューモウイルス
●ヒトメタニューモウイルスはRSウイルスと密接に関連しており、高齢者または併存疾患を有する患者において人工呼吸器を必要とする重篤な感染症をしばしば引き起こします(PMID=31342206)。
→原因不明の肺炎でヒトメタニューモウイルスだったという事を聞きます。検査ができるので、疑わしきは積極的に検査をしても良いかもしれません。
ライノウイルス/エンテロウイルス
●年間を通して流行するピコルナウイルス科のウイルスで、免疫不全患者の下気道感染の原因となります。
●重症血液疾患患者ではICU入室時の両ウイルスの検出率が最も高かったという報告があります(56%)(PMID=30230909)。
市中感染呼吸器ウイルス(CARV)感染症のリスク
●リスクは細菌性肺炎と重複しており、重症肺炎患者では両者の共感染が一般的です。
●ステロイド療法、血液悪性腫瘍、リンパ球減少症、高齢、造血幹細胞移植はウイルス感染症と強く関連します(PMID=31222287)。
●ウイルス性肺炎は冬と春にピークを持つ季節性分布があるようです(PMID=30230909)。
市中感染呼吸器ウイルス(CARV)感染症の診断
●細菌性肺炎ではびまん性の気道パターンが多いですが、ウイルス感染症では症状や画像所見に特異的なものはありません。主な所見はTree-in-budとスリガラス影です(PMID=29757717)。
→Tree in budと言えば、結核と教わりましたが、ウイルス性肺炎でも見られるよう…
●診断は各種検体中のウイルスの同定に寄ります。市中感染呼吸器ウイルス(CARV)は培養、血清学、酵素免疫測定(EIA)、免疫蛍光染色、またはPCRに基づいて同定できます。
●PCRの技術は培養にとって代わってきており、現在はスタンダードな診断方法とされています。
●IDSAは急性呼吸器症状を呈する全ての免疫不全患者にインフルエンザの検査を行う事を推奨しています(PMID=30834445)。
●PCR検査は2-3時間以内に複数の呼吸器ウイルスを同時に検出する事ができます。
●ただし、各種ウイルスの検出に最も適した検体の種類(鼻/咽頭スワブ/BAL/細胞診検査/肺生検)は未だ不確実です。
●検体を採取する際の重要な検討事項は患者の状態です。
●機械換気を受けている患者では上気道検体でインフルエンザが陰性であっても、気管内吸引液またはBAL液を採取するべきです(PMID=30834445)。
● BALを基準とした呼吸器内科病棟患者を対象とした研究では、鼻咽頭PCR検査の陽性予測値は88%、陰性予測値は89%でした(PMID=28382762)。
●別の問題点としてはウイルスが同定されたとしてもそれがコロニーか感染を起こしているか判断が難しい場合がある事です(PMID=30230909)。しかし、インフルエンザが検出された場合、一般的には感染を疑います。
●RSウイルスの場合、検査が有用である場合があります。造血幹細胞移植患者の1/3の血漿からRSウイルスRNAが検出され、予後不良と関連していたという報告があります。
市中感染呼吸器ウイルス(CARV)感染症の治療
●WHOとCDCはいずれもインフルエンザの第一選択薬はオセルタミビルを推奨しています。ステロイドは他の症状が強くない限り推奨されません。
●重症患者の適切な治療期間は不明ですが、長期間治療が必要な場合があります。
●免疫グロブリンとリバビリンの静脈内投与によるRSウイルスの治療が提案されていますが、議論の余地があります(PMID=21139081)。
市中感染呼吸器ウイルス(CARV)感染症の予後
●最近の報告では重症血液疾患患者における市中感染呼吸器ウイルス(CARV)の有病率は市中肺炎の有病率と同等でしたが、前者の方は死亡率が2倍であったといいます(PMID=30230909)。同様の事は同種造血幹細胞移植を受けた患者でも言えます。
●重篤なインフルエンザ感染症の免疫不全患者では1/3がICUへ入院し、人工呼吸器管理を必要とし、1/5が致死的な転機となるとのことです(PMID=26384310)。
肺炎の原因となり得る全身性ウイルス感染
●これらのウイルスは生涯感染を確立する事が知られており、免疫抑制のエピソードの際に再活性化します。
●免疫不全患者では全身性ウイルス感染の最も一般的な原因はDNAウイルスです。肺炎の原因となるヘルペスウイルスには単純ヘルペスウイルス1/2型(HSV-1, HSV-2)、水痘帯状疱疹ウイルス(VZV)、サイトメガロウイルス(CMV)があります。
●アデノウイルス科にはヒトアデノウイルス(HAdV)A~Gが含まれ、それぞれ異なる臨床像を呈します。
●免疫不全患者ではHAdVは致死的な多臓器障害を起こす可能性があります(PMID=30524972)。
全身性ウイルス感染症のリスク
●ウイルス感染症はT細胞欠乏症の患者で最も一般的で、高用量ステロイド(20mg/日以上、4週間以上)を服用している患者、またはT細胞欠乏性造血幹細胞移植を受けている患者、またはアレムツズマブやフルダラビンによる治療を受けている患者では特に注意が必要です(PMID=26193852)。
●ウイルス感染は、市中感染または日和見感染、潜伏感染の再活性化によるもの、移植ドナーからのもの、移植レシピエントからのもの(例えば、血清陰性患者が血清陽性ドナーから固形移植を受けた場合、または血清陽性レシピエントが血清陰性ドナーから造血幹細胞移植を受けた場合のCMVの再活性化)があります(PMID=30146024)。
全身性ウイルス感染症の診断
●免疫抑制のある患者では、全身性ウイルス感染症の臨床像は、原因菌および免疫抑制の程度によって大きく異なります(下記表を参照)。

●肺病変がある場合、呼吸器症状は非特異的(頻呼吸、呼吸困難、低酸素)となります。
●肺病変は典型的にはcrazy-pavingパターン、スリガラス影、小結節、浸潤影などです。
●CMV肺炎の確定診断には、肺炎の臨床症状と、ウイルス分離、迅速培養、病理組織学、免疫組織化学、またはDNAハイブリダイゼーション技術による肺組織中のCMVの同定が必要です。
●推定CMV肺炎とは、肺炎の臨床症状または徴候と、ウイルス分離、迅速BAL液培養、またはBAL液中のCMV DNA定量によるCMV検出を組み合わせたものと定義されます。
●しかし、CMV DNAの信頼できるカットオフ値は確立されていません。
●さらにウイルスの排出は下気道でも起こる可能性があり、そのため無症候性感染症の患者では上気道でCMV DNA量が低い可能性があります(PMID=27682069)。
●一方でBAL液のCMV DNA検査が陰性である場合はほぼ100%と断定できます(ただし十分な検体が得られたと仮定して)。
●VZV肺炎は通常、典型的な皮疹によって診断されますが、重度の免疫不全患者では発症しない事があります(PMID=28592328)。ほとんどの場合、VZVはBAL液中に認められます。
●HSV肺炎は重症患者では血液、唾液、または咽頭での再活性化が頻繁に起こるため、診断がより困難です。下気道でHSVが検出されても単にコンタミを起こしているだけかもしれません。
●HSV肺炎の診断はBAL液中のHSV検出とBAL細胞中の特異的な核内包物の証明にかかっています(PMID=17234903)。気管支鏡では稀ですが、気管支病変が見られることがあります。
全身性ウイルス感染症の治療
本Reviewでは治療に関しては書かれていませんでした。各種抗ウイルス薬を使用しろ、という事でしょうが、治療期間については正直不明な点が多い所です。また、無症候性の患者でウイルスが検出されたときに治療すべきか、など、治療適応の問題も多く残っていると思います。
侵襲性真菌感染症
●真菌性肺感染症の最も重要な3つの原因は、Pneumocystis jirovecii、Aspergillus spp.およびCryptococcus spp.です(PMID=9624195)。

H&E: ヘマトキシリンとエオシン、GMS: グロコットメテナミンシルバー、PAS: 過ヨウ素酸シッフ、HSCT: 造血幹細胞移植、SOT: 固形臓器移植、AIDS: 後天性免疫不全症候群、胸部のHRCT: 高解像度コンピューター断層撮影、BAL: 気管支肺胞洗浄、GM: ガラクトマンナン、BDG: ベータ-dグルカン、Se: 感度、Sp: 特異性、PCR: ポリメラーゼ連鎖反応、AML: 急性骨髄性白血病、ALL: 急性リンパ芽球性白血病、HIV: ヒト免疫不全ウイルス、TMP/SMX: トリメトプリム/スルファメトキサゾール、TNF: 腫瘍壊死因子、CNS: 中枢神経系、CSF: 脳脊髄液
画像のソース:公衆衛生画像ライブラリ、CDC(https://phil.cdc.gov)
Pneumocystis jirovecii
●Pneumocystis jiroveciiは、無症候性保菌者から免疫不全宿主に感染する病原体です。
●主な感染リスクは、ステロイド、急性リンパ性白血病、造血幹細胞移植、固形臓器移植、多くの原発性免疫不全、T細胞を減少させる治療法などです(PMID=25269391)。
Aspergillus spp.
●アスペルギルス属菌は、肺および副鼻腔に感染症を引き起こす真菌です。
●主な感染リスクは重度で長期にわたる好中球減少症、急性骨髄性白血病、造血幹細胞移植、高用量ステロイド療法、および慢性的にT細胞を障害する薬物または状態です。
●侵襲性アスペルギルス症(IA)は、例えば建設現場などで重い真菌曝露にさらされた患者で起こる事が最も一般的です(PMID=25870328)。
●固形臓器移植後12ヵ月後のIAの累積発生率は、ある研究では0.7%であり、肺移植患者で最も高い結果でした(PMID=20218876)。
●造血幹細胞移植を受けた患者では、12ヵ月後の発症率は1.6%であったという報告があります(PMID=20218877)。
Cryptococcus spp.
●クリプトコッカス属菌は、T細胞を介した応答が障害された患者の肺および中枢神経系に影響を及ぼす可能性のある酵母です。
●C. neoformansおよびC. gattiiがクリプトコッカス症のほとんどの症例を占めています。
●休眠菌の再活性化が肺病変の主なメカニズムであると考えられています。
●肺クリプトコッカス症の発症リスクには、悪性腫瘍、造血幹細胞移植、固形臓器移植、肝硬変、慢性腎臓病、慢性肺疾患、糖尿病、ステロイドまたはTNFα拮抗薬による治療が含まれます(PMID=11477526)。
●固形臓器移植を受けた患者では、クリプトコッカス症は浸潤性真菌感染症の約8%を占め、全体の発生率は0.2~5%であったと報告されています(PMID=19402789)。
その他
●Mucorales(ムコール症の原因真菌)は、血液悪性腫瘍患者、造血幹細胞移植を受けた患者において、侵襲性の強い感染症を引き起こします。
●フザリウムは、主に血液学的悪性腫瘍患者および造血幹細胞移植を受けた患者に感染し、肺および副鼻腔を侵します。
肺真菌症の診断
●肺真菌感染症の患者は、発熱、咳、呼吸困難、胸膜痛、喀血などの非特異的な症状を呈します。肺外症状は浸潤性真菌症を疑うのに役立ちます。
●侵襲性肺アスペルギルス症(IA)ではHRCTでHalo signを伴う巨大結節、胸膜ベースのくさび状の浸潤影、または腫瘤を認めます。
●ムコール症はIAと同じ臨床所見および放射線学的所見を呈しますが、副鼻腔病変の存在、ボリコナゾール療法の既往、またはHRCTでHalo signが反転している場合には、ムコール症を疑うべきです。
●P. jirovecii肺炎では、HRCTで両側のスリガラス状の陰影が肺尖部優位で、胸膜直下がスペアされます。
●肺クリプトコッカス症の最も一般的な所見は、孤立性またはまばらで、辺縁が明瞭な石灰化していない結節であり、胸膜直下に認められることが多いです(PMID=15987984)。
●侵襲性真菌感染症(IFI)は、以下の3つに分類されます(PMID=31469325)。
-Proven(感染徴候や真菌が組織病理、細胞病理、または培養によって確認された場合)
-Probable(宿主因子、臨床基準、顕微鏡検査、培養、ガラクトマンナン抗原で診断)
-Possible(宿主因子、臨床基準に基づく)
Pneumocystis jirovecii infection
●P. jirovecii肺炎(PJP)の診断は、免疫蛍光法、定量PCR(理想的にはBAL液、それ以外の場合は誘発喀痰)による病原体の同定に依存しています。
●血清βDグルカン検査は、臨床像とPCR所見の間に矛盾がある困難な症例や、PCR所見がグレーゾーンにある場合のコロニー化と感染の違いを明らかにするために有用です。βDグルカンが陰性であればPjPを除外できます(PMID=27550991)。
●HIV陰性の免疫不全患者を対象とした研究では、BAL液での定量PCRは感度87%、特異度92%で、感染とコロニー化の鑑別に役立ったといいます(PMID=19265086)。
●メタアナリシスによると、血清βDグルカンは感度95%、特異度86%です(PMID=22329494)。
Aspergillus infection
●侵襲性アスペルギルス症(IA)では、BAL顕微鏡と培養により、分岐した隔壁を持つ菌糸を認めます。
●Aspergillus spp.は2~5日で増殖しますが、培養では検出感度が低いです。
●血液悪性腫瘍、造血幹細胞移植、固形臓器移植などでリスクの高い患者で侵襲性アスペルギルス症が疑われる場合には、血清アスペルギルスPCRとガラクトマンナン(GM)検査が推奨されます。
●PCRとGM検査は血清よりもBAL液の方が良好な結果が得られることがありますが、気管支鏡/肺胞洗浄はリスク/ベネフィットを慎重に評価したのちにのみ行うべきです(PMID=31469325)。
●血清βDグルカン検査はハイリスク患者には推奨されますが、侵襲性アスペルギルス症に特異的ではありません。2015年のシステマティックレビューでは、IAを診断するための感度と特異度は血清GMで81.6%と91.6%、血清BDGで76.9%と89.4%であったのに対し、PCRでは感度77~88%、特異度75~95%であったことが明らかになりました(PMID=26113653)。
Mucormycosis
●ムコール症の診断は、検体の顕微鏡検査、培養、および病理組織学によって行われます。
●免疫組織化学は100%の感度と100%の特異度を持ちます。MucoralesはBDグルカンもGMも含まず、HRCT所見が侵襲性真菌感染症と一致する患者では、これらの検査で陰性の結果が得られた場合は、ムコール症を示唆しています(PMID=24479848)。しかし、アスペルギルス感染を併発している可能性があります。
Cryptococcus infection
●クリプトコッカス肺炎の診断は、分離しているか中枢神経系の病変を伴うかにかかわらず、顕微鏡による病原体の確認、または脳脊髄液、血液、喀痰の培養による検出に依存します。その中でクリプトコッカスは2~3日以内に増殖します。
●クリプトコッカス抗原アッセイはHIV陽性患者よりもHIV陰性患者の方が感度が低いです。クリプトコッカス肺炎を有するHIV陰性免疫不全患者では56~83%の値が報告されています(PMID=18171241/18171241)。
新しい検査
●真菌感染症患者の早期診断を可能にする新しい診断法が開発されています。
●ムコラレス特異的抗原またはT細胞のアッセイやムコラレスPCRは、培養に比べて早期に陽性となる良好な感度と特異性を示しています(PMID=26706615)。
●侵襲性真菌感染症患者では、汎真菌血清二糖類を検出する質量分析法は、浸潤性カンジダ症および侵襲性アスペルギルス症の診断にそれぞれ51%および64%の感度を示し、それぞれ87%および95%の高い特異度を示しました。ムコール症については、定量PCR法と同様に診断に寄与しました(PMID=30787140)。
肺真菌症の治療
●PJPはトリメトプリム-スルファメトキサゾールで治療されています(PMID=27550991)。重症型のステロイド療法の追加は、現在のところHIV陰性患者には推奨されていませんが、ランダム化対照試験(NCT02944045)で評価されています。
●侵襲性アスペルギルス症はボリコナゾールで治療されます(PMID=29544767)。
●ムコール症の第一選択薬はリポソームアムホテリシンBですが、イサブコナゾールも有効な代替薬です(PMID=28011902)。
●重度クリプトコッカス肺炎では、アムホテリシンBとフルシトシンの後にフルコナゾールが必要です(PMID=20047480)。
●フザリウム感染症はボルコナゾールまたはアムホテリシンBで治療されます(PMID=24548001)。
肺真菌症の予後
●生存率は時間の経過とともに改善していますが、侵襲性アスペルギルス症は造血幹細胞移植後にしばしば致命的な合併症であることに変わりはありません。
●侵襲性アスペルギルス症が原因で急性呼吸不全を発症した血液悪性腫瘍患者のレトロスペクティブ研究では、1年死亡率は72%でした(PMID=31599334)。
●移植患者の死亡率は49.4%で、固形臓器移植後(34.4%)よりも造血幹細胞移植後(57.5%)の方が死亡率が高かったです(PMID=20450350)。
●PJPはHIV陽性患者よりもHIV陰性患者の方が致死率が高く、HIV陰性患者では、死亡率は基礎疾患に応じて18%から50%と大きく異なります(PMID=11914999)。
●ムコール症患者では最大66%の死亡率が報告されています(PMID=16080086)。
寄生虫感染症

●多くの寄生虫が免疫不全患者の呼吸器感染症を引き起こします(PMID=24995332)が、最も一般的な2つの寄生虫はToxoplasma gondii(トキソプラズマ症)とStrongyloides stercoralis(糞線虫症)です。治療せずに放置するとかなりの死亡率を伴います。
Toxoplasma gondii感染症のリスク
●T. gondiiの再活性化を促進する因子には、T細胞免疫の低下、HIV感染、血液悪性腫瘍、造血幹細胞移植、固形臓器移植が含まれます(PMID=23994819)。
●ある報告では同種造血幹細胞移植後、患者の16%がルーチン血液PCR陽性で、6%が浸潤性疾患を有していたといいます(PMID=15614694)。そのリスクは、血清が陽性の同種造血幹細胞移植を受けたレシピエントで最も高かったです(PMID=30014843)。
●固形臓器移植を受けた患者のデータがまばらであることから、そのリスクは低いことが示唆されていますが、血清陰性のレシピエントが血清陽性ドナーからT. gondiiを獲得するリスクは臓器の種類によって異なり、心臓移植後に最も高いとされています(PMID=30014843)。
●固形腫瘍患者に関するデータは少ないですが、トキソプラズマ症はがん化学療法を受けている患者では稀にしか報告されていません(PMID=8274608)。
Toxoplasma gondii感染症の診断
●免疫不全の患者では、発熱がトキソプラズマ症の症状として現れ、多臓器不全に進行することがあります。
●播種性トキソプラズマ症の症状は非特異的です。肺および中枢神経系が関与していることが多く、肝炎、心筋炎、脈絡網膜炎を発症することがあります(PMID=27531150)。●その他の特徴としては、リンパ球減少症、血小板減少症、横紋筋融解症、LDH上昇があります(PMID=23994819)。
●肺に孤発性の病変を有する稀な症例では、間質性肺炎、PJP、またはCMV肺炎を模倣することがあります。
●CTでは、大葉性の浸潤影、スリガラス影、および葉間隔壁の肥厚を示すことがあります(PMID=27531150)。
●血清検査は免疫不全の患者では信頼性が低いですが、以前に血清陰性であった患者では有用と考えられます。
●診断は、血液およびBAL液のPCR、および染色されたBAL液の塗抹標本の鏡検に基づいて行われるます(PMID=30900295)。
●移植患者を対象とした研究では、血液PCRは感度が90%でした(PMID=30014843)。
Toxoplasma gondii感染症の治療・予後
●治療はピリメタミン、スルファジアジン、ロイコボリンの少なくとも6週間の導入療法と、その後の低用量維持療法で構成されています(PMID=30900295)。
●肺を含む播種性トキソプラズマ症の予後は厳しく、ICU患者の死亡率は78%です(PMID=30014843/23994819)。
Strongyloides stercoralis感染症のリスク
●Streptococcus stercoralisは土壌を含む幼虫との接触によりヒトに感染する線虫です。
●有病率は地理的地域によって異なり、アフリカ、南米、およびアジアが流行率の高い地域となっています。
●全世界で約3,000万~1億人が感染している可能性があるようです(https://www.cdc.gov/parasites/strongyloides/epi.html)。
●先進国では、糞線虫症は、移民、観光客、流行地域から帰国した軍人などに見られます(PMID=23875033)。
●ある腎移植候補者の米国のコホートでは、9.9%がS. stercoralisの血清陽性であったといいます(PMID=31363770)。
●危険因子には、裸足での歩行、土壌との皮膚接触を伴う作業、劣悪な衛生状態が含まれます(PMID=23875033)。
Streptococcus stercoralis hyperinfection syndrome(SSIS)
●Streptococcus stercoralis hyperinfection syndrome(SSIS)は、慢性的に感染した患者が免疫抑制状態(特にステロイド投与を受ける状態)になった場合、または免疫抑制状態にある患者が急性糞線虫症を発症した場合に起こります。
●これは、幼虫の過剰増殖が制御できず、肺、肝臓、脳などの末梢臓器へ播種が起こった状態です(PMID=23900531)。
●HTLV-1感染もまた、SSISの主要な危険因子である(PMID=15771684)。
●患者は咳、発熱、喀血、喘息、急性呼吸不全などの非特異的な呼吸器症状を呈します。
●消化器症状には、イレウスや出血が含まれます。
●胸部画像検査では、結節、網状、肺胞病変を呈し、これは浮腫、出血、および肺炎の合併を反映している可能性があります。
●グラム陰性桿菌の敗血症は、腸壁への幼虫の侵入が細菌の転座を促進するため、SSISの一般的な合併症です(PMID=26008854)。
●SSISの間、糸状虫の幼虫は喀痰、BAL、胸水、または腹膵などの体液中で発見されることがあります。
●好酸球増多はほとんどの免疫不全患者にみられますが、血清学的検査の信頼性が低い免疫不全患者にはみられないことがあります(PMID=23900531)。
●SSISの非特異的な症状を考慮すると、鑑別診断は広範であり、肺出血、急性呼吸不全、敗血症のすべての原因が含まれます。
●イベルメクチンが第一選択の治療法です。
●治療は、最後に便中に虫体を認めてから2週間後まで継続され、完全な自己感染サイクルをカバーします。
●SSISは放置すると常に致命的で、ICU患者の60%の死亡率が報告されています(PMID=26008854)。
【参考文献】
Elie Azoulay, et al. Intensive Care Med . 2020 Feb; 46 (2): 298-314. "Diagnosis of severe respiratory infections in immunocompromised patients" PMID=32034433
今すぐ使える血ガスの読み方2020
研修医向けに血液ガスの読み方のレクチャーをしました。
もはや専門でなく、血液ガスもそんなに頻繁に採取している訳ではないのですが、
非専門の立場から『ここだけ押さえておくべき』という所だけをまとめたものです。
専門家からの指摘・修正をお待ちしております。
コメディカルの方にもご覧いただける内容になっているかと思います。
また、今回はダウンロード可能にしています。必要でしたら『Slide share』サイトにてダウンロードをしてください。
Seronegative vs Seropositive RAの治療反応性
前回、DMARDsによる治療開始前の患者でSeronegative RAとSeropositive RAのベースラインでの疾患活動性や超音波での滑膜炎の程度を比較した論文をご紹介しました。
『Seronegative RAの方が疾患活動性が高い』という結果でしたが、同じ患者さんたちを2年間外来経過を追った結果が論文まとめられました。
前回の結果についてはこちら。
患者さんは前回と同じでARCTIC試験(NCT01205854)に組み込まれた方で、2010年ACR/EULAR分類基準を満たす230人の関節リウマチ患者を対象としています。
→前回よりも4名少なくなっています。
早速結果です。
Results
Seronegative RAとSeropositive RAの比較
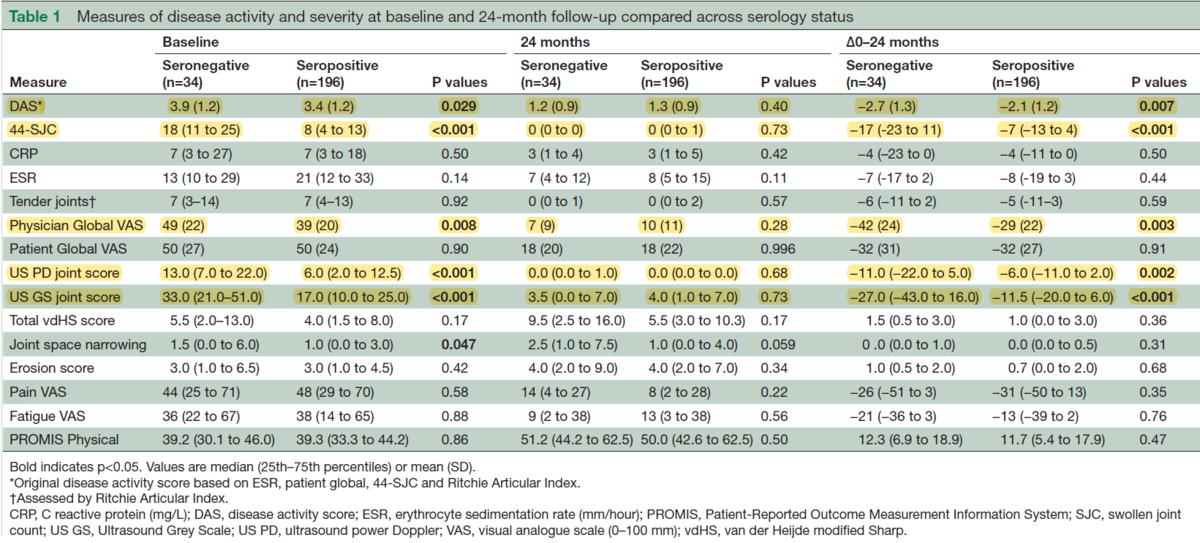
上の表は、Seronegative RAとSeropositive RAで治療開始前(前回の結果とほとんど同じ)、24か月後、その間の各項目の変化率を比較したものです。
これを見ると、疾患活動性を表すDAS、腫脹関節数を示す44-SJC、医師の総合評価であるPhysician Global VAS、超音波で滑膜の血流信号を示すUS PD joint score、滑膜肥厚を示すUS GS joint scoreが、治療開始前のベースラインでSeropositive RAと比較してSeronegative RAでは高い事が分かります。
逆にそれらの項目は24か月後ではSeropositive RAとSeronegative RAでは有意な差がなくなっている事が分かります。
つまりは表の一番右でも示されているように、Seronegative RAで上記の活動性を示す指標は著明に治療に反応して変動している事が分かります。言い換えると『Seronegative RAでは治療反応が良い』という事が言えます。
各項目の時間的推移
さて、次はそれぞれの項目の時間的な推移をグラフにした図をお示しします。
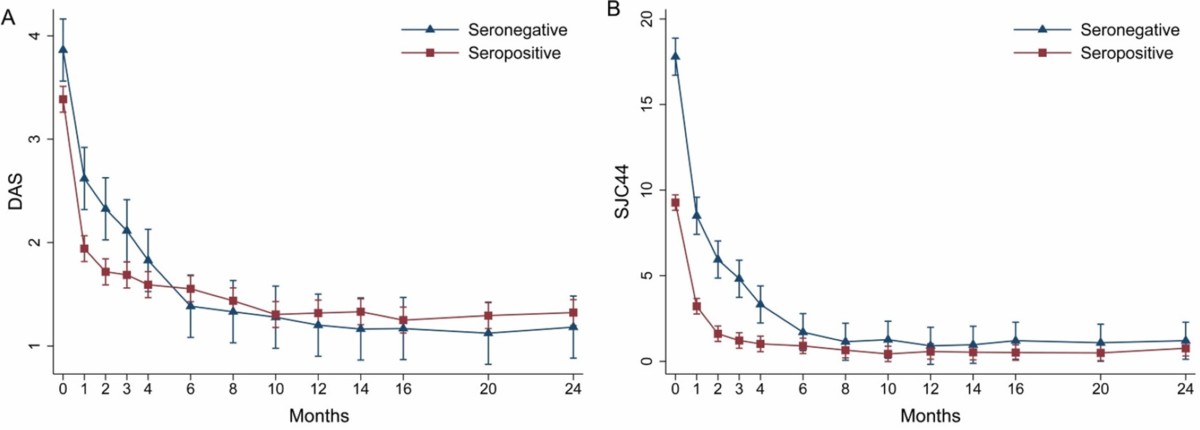
まず、図Aの疾患活動性を表すDASですが、治療開始6か月後まではSeronegative RAの方がSeropositive RAよりも疾患活動性が高い事が分かります。その後はSeronegative RAの疾患活動性が低下し、治療開始24か月後はSeropositive RAとそれほど差がなくなっています。これを言い換えると『Seronegative RAは治療の反応性が遅い可能性がある』と言えます。同様の事は図Bの腫脹関節数においても言えます。
続いて超音波での滑膜血流信号(図C)と滑膜肥厚(図D)のスコアの推移を示した図です。
これらは端的にエコーでの滑膜炎の程度を示しています。
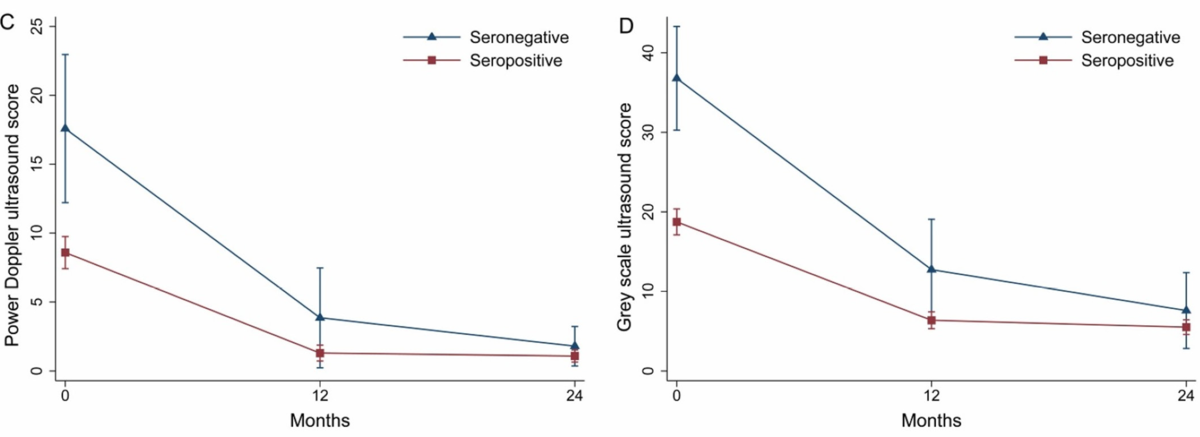
治療開始前はエコーでの滑膜炎の程度はSeronegative RAで有意に高いですが、12か月後、24か月後ではSeronegative RAでやや高いですが、有意差はなくなっています。
つまりは治療に反応して滑膜炎が改善している事が言えます。
続いて放射線での骨病変の進行を見た図(E/F)です。
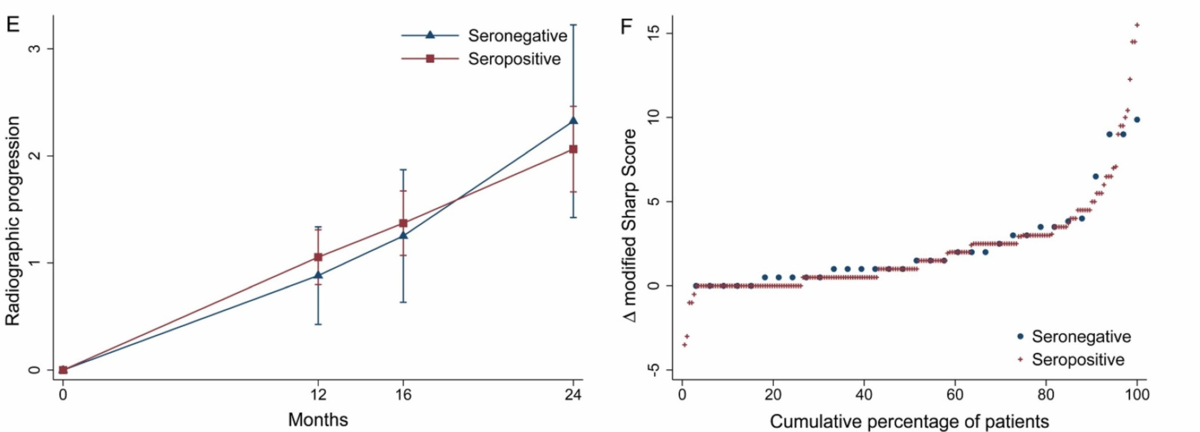
Seronegative RAとSeropositive RAでは放射線学的変化は有意な差はありませんでした。逆に言えば『Seronegative RAでもSeropositive RAと同等なくらい骨病変が進行する』という事が言えると思います。
Seronegative RAとSeropositive RAの治療反応性
次は治療の反応性を数値化したものです。EULAR good/moderate response(ΔDAS>0.6)、ACR50、ACR/EULAR Boolean remission(最も厳しい寛解基準)の3つの治療反応性基準の達成率をSeronegative RAとSeropositive RAのそれぞれで、治療開始3か月後、6か月後、ものによっては12か月後、24か月後と比較しています。
これを見ると、治療開始3か月時点ではおおよそ全ての治療反応性の基準の達成率はSeropositive RAで高い事が分かります。しかし6か月後になるとその差はなくなっている事が分かります。最も厳しいBoolean寛解基準でさえ達成率は、治療開始6か月後、12か月後、24か月後でSeronegative RAとSeropositive RAでは有意な差はなくなっています。
つまり、前述したように『Seronegative RAでは早期の治療反応性はSeropositive RAと比較して遅いが、6か月を超える頃にはSeropositive RAと同じくらい治療反応性が良い』が言えます。
なお、本文に詳細は示されていませんが、治療に関してはSeronegativeとSeropositiveと同様な治療を行ったとのことです。メトトレキサートと3剤併用療法の使用率は6か月と24か月時点で同じでしたが、生物学的製剤は6か月時点でSeronegative RA患者で11.8%であったのに対して、Seropositive RAでは5.1%と、Seronegative RAの方がむしろ使用されている傾向があったと言います(p=0.13)。
My comments
●今回の論文はいわば前回の論文(SeronegativeとSeropositive RAの治療開始前の疾患活動性について)の患者さんを2年間フォローした結果を見た論文です。
●これを見ると『Seronegative RAは治療開始前の疾患活動性はSeropositiveよりも高いが、治療をするとSeropositiveよりも反応が良い』事が分かります。
●一方で、『Seronegative RAは治療開始3か月までは治療反応性が見られず、6か月後頃からSeropositiveと同じくらいの治療反応性になる』ようです。
●もう一つ注意しなければならないのはSeronegative RAでもSeropositiveと同じくメトトレキサートを使用したり、有意差はないもののSeropositive RAよりも生物学的製剤を使用している点です。治療開始後のX線での骨病変の進行はSeropositive RAと同等であったという事なので、これは『Seronegative RAでもちゃんと治療しないといけない』という事を意味するかもしれません。
●『Seronegative RAは本当に他の疾患を除外できているか』という永遠の問題が残りますが、リウマチ専門施設で2年間もフォローしているので、さすがに他の疾患の可能性が含まれる可能性は極めて低いのではないかと考えています。出ているのであれば、研究として成り立ちませんので。
【参考文献】
Lena Bugge Nordberg, et al. RMD Open. 2018 Nov 16; 4 (2): e000752. "Comparing the disease course of patients with seronegative and seropositive rheumatoid arthritis fulfilling the 2010 ACR/EULAR classification criteria in a treat-to-target setting: 2-year data from the ARCTIC trial" PMID=30564452
