関節リウマチに限らず『朝のこわばり』は炎症性関節炎を示唆する特徴的な所見です。
『夜間にずっと動かないから、炎症を起こしている関節が固まってしまう』と教わって来ましたが、朝のこわばりが何故起こるのか、ちゃんと考えた事がありませんでした。
しかし、最近『概日リズムが炎症性関節炎に関係する』という論文を発見しました。
また、それらに関連して『時間生物学・時間治療』という概念がある事を知りました。
今回はこの『概日リズムが炎症性関節炎の関係性』から『朝のこわばりが発生する機序』そして『時間生物学・時間療法』ついて迫ってみたいと思います。
この概念、めちゃくちゃ面白いです!!
はじめに
●2017年のノーベル医学生理学賞は、明暗24時間周期に基づく末梢の概日リズムを調節する遺伝子やタンパク質のネットワークを発見した科学者に授与されている。
※概日リズムという言葉は良く効いていましたが、分子学的な発見は、意外と歴史が浅い事に驚きました。

図1:概日リズムと炎症反応
●サーカディアンリズム(概日リズム)は、明暗24時間周期に基づいて、中枢神経系と末梢細胞内の両方に由来する。
●メラトニン(暗闇で分泌される)とコルチゾール(光で分泌される)は、夜間(睡眠中)の免疫炎症反応をそれぞれ活性化、抑制する。
●その結果、末梢血単核球をはじめとする様々な免疫応答メディエーターやサイトカインの濃度は日々変動している。
※メラトニンが免疫炎症反応を活性化するなんて、知っていました!?驚きです…
●ヒトでは、概日リズムは地球の一日の自転周期に同期している。分子間相互作用の複雑なシステムが細胞の24時間リズムを調節しているが、このサイクルは通常、中枢と末梢の両方のメカニズムによって維持され、調整されている。
●より詳細には、概日リズムは、ペースメーカーである脳の視交叉上核(SCN)に由来し、SCNはメラノプシンを含む光感受性の高い網膜神経節細胞と直接連結している。そしてこのプロセスに沿って内部の概日リズムを形成することで、末梢に投影される(図1)。
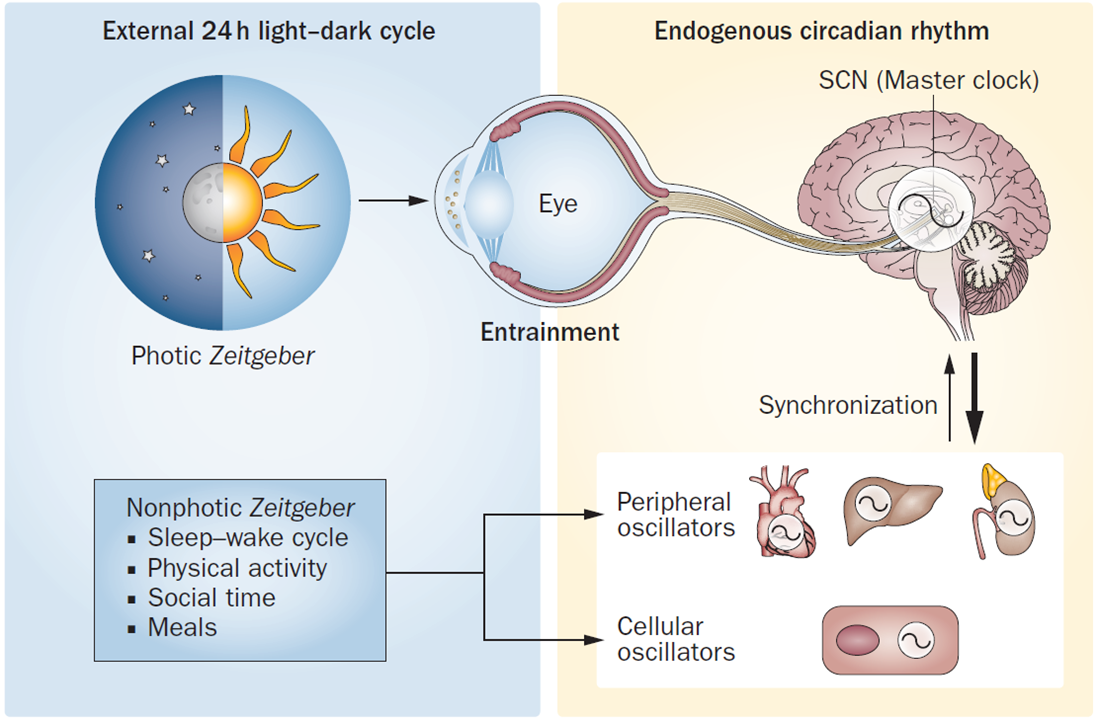
※上図はNat Rev Rheumatol. 2015(PMID=25800214)より引用した図ですが、要は視交叉上核がペースメーカーで、網膜神経節細胞と連携をとって概日リズムが作り、それが末梢組織に投影されているという事です。
●概日リズムが乱れる原因として考えられるのは、体内時計と環境(明暗)とのずれを引き起こす時差ぼけや、夜勤労働者の状態など。
●概日リズムは、睡眠、摂食時間、エネルギー代謝、そして重要な内分泌機能と免疫機能を含むいくつかの活動を調節している。
●これらのリズムの乱れ、主に覚醒・睡眠、ホルモン分泌、摂食の乱れは、気管支喘息や関節リウマチなどのアレルギー性疾患や自己免疫疾患だけでなく、肥満やメタボリックシンドロームの発症にも関与している。最近の研究では、関節リウマチ患者の健康関連QOL(HRQoL)を予測する睡眠/覚醒リズム関連パラメータを特定することを目的としている(PMID=29374666)。
※生活リズムの乱れが生活習慣病の発症に関連する事は考えるに容易いですが、アレルギー疾患、自己免疫疾患の発症にも関連するのは興味深いです。
概日リズムと免疫機能
●末梢血単核球などの免疫応答メディエーターやサイトカインの濃度など、多くの免疫応答メディエーターは日々変動している(PMID=23697902)。
●さらに、造血幹細胞といくつかの成熟白血球数は、夜間に循環血液中でピークを迎え、日中に減少する(PMID=23391992)。
●ほとんどの免疫細胞は概日時計遺伝子を発現しており、24時間のリズムで発現する遺伝子の幅広い配列を提示している(PMID=29846607)。
●このリズムは、サイトカインやケモカインの夜間合成と分泌を含む細胞機能に重大な影響を与えるとともに、パターン認識受容体(PRR)を介して、炎症や感染した組織への細胞移動、貪食、細胞溶解活性、病原抗原に対する増殖反応などのサーカディアン免疫系の機能を調節しており、これらはすべて深夜にピークを迎える(★PMID=25900041/18190882)。
※ここまでで、かるくカルチャーショックを受けています。全ての免疫細胞が概日時計遺伝子を発現していて、炎症を起こす反応にリズムがあり、夜間に悪化するという事が大変面白い話です。
●免疫系の活性化は、徐波睡眠(ノンレム睡眠)を誘発することで感染に対抗し、病原体への抵抗力を高めるとされるが、これはおそらく徐波睡眠を誘発することが知られているTNF-α、IL-2、またはIFN-γなどの炎症性サイトカインの産生を介していると考えられている(PMID=7795895)。
●また、グラム陰性菌の外膜の主要成分であるリポ多糖類(LPS)は、これらのサイトカインの分泌を増加させる。LPS依存性のTNF-α分泌は、昼間に比べて夜間に有意に高く、夜間ホルモンであるメラトニンによってさらに増強されるという報告がある(PMID=16014678)。
●最近、TNF-αが関節リウマチの滑膜細胞においてカルシウム依存性の二重経路を介して概日時計遺伝子Bmal1の発現を誘導することが明らかになり、さらに免疫炎症応答メディエーターが概日メカニズムに影響を及ぼす事を支持している(PMID=29217191)。
●別の研究では、関節炎のマウスモデルで炎症を起こした関節内での分子時計の活性化を実証しており、線維芽細胞様滑膜細胞(FLS)のような関節に常駐する炎症細胞が局所でリズムのある炎症シグナルの源となっている可能性があることを強調している(PMID=27488122)。
※前半では免疫細胞や炎症性サイトカインが概日リズムを有する事を言っていますが、後半では炎症性サイトカインなどが概日リズムに与える影響が述べられています。
免疫・炎症反応に対する神経内分泌系のサーカディアン制御
●中枢時計(central clock)が末梢組織に作用するメカニズムの1つには、副腎からのグルココルチコイド産生によるものがある(PMID=22018179)。
●しかし、他の多くのサーカディアンシグナル伝達メディエーターもまた、夜間神経ホルモンであるメラトニンや自律神経系のように、免疫応答を調節している。
●中枢神経系は、主に視床下部-下垂体-副腎(HPA)軸と自律神経系を使用して、ホルモンや神経信号を含むメディエーターを介して末梢時計を同期させる(PMID=26301993)。
●主なホルモンであるグルココルチコイドとカテコールアミン(エピネフリンとノルエピネフリン)は、HPA軸を介して副腎から放出されるが、ノルエピネフリンは交感神経終末からも放出される。
●HPAは、視床下部の傍室核に投射されるSCNによって制御され、これによって下垂体による副腎皮質刺激ホルモンの放出が誘導され、副腎が制御される。
●カテコラミンは、アドレナリン受容体を介して作用し、免疫細胞に多くの影響を与えるとともに、体液性免疫応答を増加させる(PMID=23391992)。
●日中は、光を誘発するシグナルがSCNを介して上頸神経節を経由して松果体に伝達される。メラトニンは概日リズムの調整を媒介する神経ホルモンであるが、夜間に松果体から産生される。
●光刺激はコルチゾール、セロトニン、ドーパミンの分泌を増加させ、一方でメラトニン、ノルエピネフリン、アセチルコリンの分泌を抑制する。血清メラトニン濃度は通常、日中には検出されないが、夜間には光刺激がない場合には有意に高くなる(PMID=12114284)。
●健常者と比較して、関節リウマチのような慢性炎症患者では深夜のメラトニン分泌が有意に増加し、疾患期間の短い関節リウマチ患者では早朝のメラトニン血清濃度が高くなる(PMID=18556443/15647428)。
●IFN-γ、IL-1、IL-6を含む炎症性サイトカインは、いずれもメラトニン刺激に反応してヒト末梢血単核球から夜間に分泌される。実際に、正常と関節リウマチの両方の滑膜組織マクロファージや体液中にメラトニン(およびその受容体)が検出されている(PMID=16014678)。
●最近では、メラトニンは、BMAL、CRYおよび/またはDEC2などの主要な概日時計遺伝子の発現の直接的/間接的な調節を介して軟骨の破壊/再生を刺激することが示されている(PMID=28585236)。
※視交叉上核が概日リズムのペースメーカーで、末梢に投影しているという事でしたが、そのメディエーターとしてグルココルチコイドやカテコラミンなどのホルモンが使われるという事です。一方で夜間に松果体から分泌されるメラトニンはIFN-γ、IL-1、IL-6などの炎症性サイトカインの分泌を亢進させるようです。
関節リウマチにおけるサイトカイン産生・生体エネルギー分布の概日リズムと臨床症状との関連性
●夜間に滑膜で上昇した炎症性サイトカインは、結果的に、朝の関節のこわばりや痛みなどの関節リウマチの原因となる(PMID=21529303/16214085/25800214)。
●メラトニン(およびプロラクチン)などの催炎症性ホルモンによって誘発されるサイトカインの分泌パターンと血中濃度は、1日24時間の厳密なサイクルに従っている。
●これらの催炎症性ホルモンは関節リウマチ症状の出現前に上昇し始める。炎症性疾患メディエーターと症状の流れを打ち消すために、内因性コルチゾールの合成が活性化される(PMID=17968333)(図2)。

図2. メラトニンによる炎症性ホルモンの分泌とコルチゾールによる抑制
●また、内因性コルチゾールの夜間分泌と末梢代謝のリズム変動や、不活性型から活性型コルチゾンへ変化し、滑膜細胞を活性化させる変化が、関節リウマチの病態生理において役割を果たしている可能性があることも考慮されるべきである(PMID=17968333)。
●関節リウマチ患者では、炎症プロセス全体が滑膜液組成の変化、滑膜組織と関節周囲構造の浮腫、および間質液の再分布を誘導するが、睡眠は異なるメカニズムで、朝に最も顕著な関節の臨床的こわばりに寄与している。
●いくつかの重要な概日リズムのプレーヤーの中で、エネルギー配分は生理過程の恒常的な調節に重要であり、24時間周期の間に様々な代謝活動に応じて毎日配分されている(図3)。

図3 概日リズムとエネルギー配分
●神経内分泌経路はエネルギー分布の観点から、エネルギー貯蔵因子(副交感神経系、インスリン、インスリン様成長因子-1など)と、エネルギー消費因子(交感神経系(SNS)、HPA軸、甲状腺ホルモン、グルカゴン、成長ホルモンなど)に分類される。
●正常な状態では、エネルギー貯蔵と使用の配分はバランスがとれており、概日リズムに従って分配され、エネルギーを消費する日常の生理的活動(すなわち、筋肉および心血管機能のための日中)にリンクしている。しかし、活動性関節リウマチのような慢性炎症状態では、免疫系の夜行性亢進による大量のエネルギー使用のために、このバランスが変化する(PMID=20705130)。
●予想されるように、睡眠中は筋肉や心血管系機能などの他のすべてのエネルギー消費活動が劇的に減少するため、エネルギーは容易に細胞増殖を含む免疫系機能のために利用できるようになる。
●それにもかかわらず、エネルギー調節は慢性炎症状態では不十分であり、悪液質、食思不振、病的行動、脂質異常症、炎症組織付近の脂肪沈着、インスリン抵抗性および高インスリン血症、交感神経系の活性化(高血圧)、軽度の高コルチゾール血症、低アンドロゲン血症、ならびに慢性炎症に関連した貧血および骨減少症を含む他の多くの臨床的異常を引き起こす(PMID=29021568)。興味深いことに、これらの条件の多くがメタボリックシンドロームの原因に関与している可能性がある。
●一般的に持続的なシフト勤務は、健康に有害であり、心血管疾患、過敏性腸症候群、メタボリックシンドローム、糖尿病、癌などの慢性疾患の発生率の増加と関連している。また、2010年の研究では関節リウマチのリスクの増加と関連するとの報告もある(PMID=29225920/20237124)。
●結論として、関節リウマチの概日リズムに関連する症状(朝のこわばりなど)は夜間に免疫システム活性化に使用されるエネルギーが豊富である事に由来するかもしれない。
※この章では、概日リズムとエネルギーの配分について述べられています。正常ではエネルギーは日中の様々な活動に配分され、夜間にそれらの活動がなくなるために、エネルギーが免疫システムに配分されるため、もともと夜間に炎症が起こりやすいと言われています。確かに抗炎症作用のある生理的コルチゾールが朝に分泌されるのは、日中に炎症を起こされたら、様々な活動が出来ないから、と考えられるでしょう。しかし慢性炎症状態では、夜間にエネルギーを大量に消費するため、日中の分が減ってしまいます。これが慢性炎症疾患患者さんの活動性の低下に関わっているのかもしれません。また様々な生活習慣病にも関連する事は興味深いです。持続的なシフト勤務(当直)が概日リズムのバランスを崩すという観点から、避けた方が良いという事でしょうか。確かに医師や看護師さん達は慢性的に疲労を抱えている印象です…
関節リウマチにおけるコルチゾールの概日性分泌
●細菌感染などの急性炎症性イベントの存在下では、HPA軸反応が活性化され、循環ACTHおよびコルチゾールの高濃度につながる。特に、敗血症の最初の数日間のような重篤な状態では、コルチゾールの毎日の産生量が18倍に増加することがある(PMID=25543020)。
●しかし、この強い副腎刺激は数日のような短期間しか持続しない。逆に、関節リウマチのような慢性炎症の存在下での炎症に伴うHPA軸活性化は、視床下部、下垂体、副腎のすべてのレベルでHPA軸に害を与え、部分的な副腎不全を引き起こす可能性がある(PMID=9100607)。
●催炎症性サイトカインであるIL-1βとTNFは、ステロイド生成のいくつかのステップを阻害する主な因子である(PMID=27042335)。
●しかし、血清コルチゾールの分泌量と分泌周期に関する概日リズムは、健常対照者と軽症から中等症の関節リウマチ患者(炎症性サイトカインが過剰の状態)では類似している。一方、IL-6の血清濃度は10倍近く高く、対照群と関節リウマチ患者では概日リズムが大きく異なっている。
●したがって、IL-6の血清濃度が上昇しているにもかかわらず、コルチゾールの概日リズムの分泌量は期待かつ要求されるようには増加しておらず、持続的に活動性のある疾患に関連した副腎の慢性ストレス下で、コルチゾールの分泌が不十分である事を示している(PMID=9100607)。
●関節リウマチ患者がグルココルチコイド治療後に臨床的に改善するのは、炎症因子の直接的な抑制に起因しているものと同時に、ステロイド環境の回復が考えられる(PMID=12508908)。
●結論として、コルチゾールは最も強力な内因性抗炎症ホルモンであるため、慢性疾患における夜間の異常な分泌量の低下は、関節リウマチ患者の早朝の関節症状を説明できる可能性があるが、対照的にメラトニンの分泌は依然として高く、夜間の炎症反応を増強する(PMID=12508908)。
※この章では、関節リウマチのような慢性炎症状態では、内因性のコルチゾールの分泌が低下している事が述べられています。たまに関節リウマチ患者さんでコルチゾールなどの副腎ホルモン値が低い方がおられますが、そうなのかもしれません。逆にこれを『副腎不全に伴う関節炎だ!』と言うCase reportもちらほら見られますが、むしろ慢性炎症に伴うホルモン分泌抑制がしっくりきます。正常ではもともとメラトニン分泌により夜間に炎症が惹起されやすく、関節リウマチではさらにこの炎症が強くなるのにも関わらず、コルチゾールの分泌まで低下したら、『朝のこわばり』を含めた関節症状が悪化するのは想像するに容易いですね。
関節リウマチにおける夜間療法とグルココルチコイド
●低用量長期グルココルチコイド治療は、内因性コルチゾール副腎産生量が減少している場合に『代替療法』として作用する可能性があるため、今日では関節リウマチにおいて推奨されている(※現在のガイドラインでは短期間に限られています)。
●実際には、外因性グルココルチコイド(すなわち治療的)と内因性グルココルチコイド(すなわち生理的)は異なる特徴を示す。
●外因性合成グルココルチコイドは、コルチゾール(ヒドロコルチゾン)と比較して、より選択的なグルココルチコイド/抗炎症作用(ミネラルコルチコイド作用が少ない)を示し、また、コルチゾール(ヒドロコルチゾン)と比べて、異なる血漿動態、生物学的半減期、代謝、および高用量時の非ゲノム作用を有する。
●いずれにしても、長期的な外因性グルココルチコイドの投与は、HPA軸機能および副腎での概日性コルチゾール産生を阻害する可能性がある。
●興味深いことに、1980年から2004年の間に行われたある最近の解析では、長期の関節リウマチ治療においてグルココルチコイドの平均投与量が10.3mg/日(プレドニゾン換算で)から3.6mg/日に減少したことが観察されており、グルココルチコイドの長期使用の正しいアプローチを示している(PMID=25228430)。
●最近、グルココルチコイドが細胞免疫に重要なゲノム・エピジェネティック効果を発揮することが明らかになり、細胞の概日リズムの存在を考えると、6時から8時の間の外因性投与による夜間の免疫細胞活性の上昇(および関連するサイトカイン合成および細胞増殖の増加)を防ぐには遅すぎるため、最適ではないかもしれない(PMID=22018182/29036586)(図4)。

図4 グルココルチコイドの投与タイミング
●関節リウマチの痛み、こわばり、機能障害は早朝に最大値を示すことが確立されているため、夜間にグルココルチコイドを利用して夜間の炎症性サイトカインの上昇を防ぐことは、朝に確立された症状を治療するよりも効果的であることが明らかになっている(PMID=16126979/27042335)。
●さらに、関節リウマチやリウマチ性多発筋痛症の、痛覚を代表とする中枢神経系を含む多くの炎症経路は、グルココルチコイド時間療法によってより良く制御され、その結果、睡眠の質が向上し、抑うつ症状が軽減される可能性がある(PMID=23415134)。
●加齢により、グルココルチコイドのより慎重な管理の必要性が高まる可能性さえある(PMID=11511399)。
※以下にいくつかの試験を述べます。
●関節リウマチにおいて、グルココルチコイドの夜間投与が朝投与よりも優位である事を示す最初の信頼性の高い臨床研究が1964年に発表された(PMID=14130037)。
●20年後の1984年には、低用量のプレドニゾロン(平均5.8mg/日)で治療された関節リウマチ患者41人が二重盲検クロスオーバー試験に参加し、プレドニゾロンの投与時期(朝または夜)が朝のこわばりに及ぼす影響が再検討された(PMID=6395813)。
→2種類の異なるレジメンが採用された:就寝時(22:00-23:00)と起床時(6:00-7:00)に錠剤(<5mg/日のプレドニゾロン)が投与された。ここでも夜間にプレドニゾロンを投与した場合、朝のこわばりの持続時間は朝に同じ量を投与した場合と比較して有意に短かった(P=0.0001)。
※プレドニゾロンの半減期は27時間前後なので、朝に内服しても、夜に内服しても、一応は1日は持つはずですが、血球濃度の上がりを考慮すると、やはり炎症が惹起される夜間の前に内服する方が効果的という事だと思いました。
※ただし、注意すべきは、朝のこわばりは患者さんの主観であるため、いつもと異なる介入をされるとそれだけでバイアスがかかってしまい、こわばりの自覚時間が短縮する恐れがあるという事です。
●最後に、1997年にグルココルチコイド治療を受けた関節リウマチ患者26人を無作為に2群に分け、午前2時または7時30分に低用量のプレドニゾロンを投与した(PMID=9059137)。
→午前2時に低用量のプレドニゾロン(1日5または7.5mg)を投与したわずか5日後、朝のこわばりの持続時間(P<0.001)、関節痛(P<0.001)、Lansbury指数(P<0.001)、Ritchie指数(P<0.001)、および朝の血清IL-6濃度(P<0.01)に非常に良好な効果が認められた。他の試験群(午前7時30分)では、軽度ではあったが、朝のこわばり(P<0.05)とIL-6の血中濃度(P<0.05)に限定的だが、有意な効果が認められた。
●この研究は、低用量のグルココルチコイドを、IL-6の合成亢進で定義される炎症活動の活発な時間(夜間)に先行して投与した場合に、急性関節リウマチ症状を改善できることを確認した。
※確かに夜間にグルココルチコイドを投与する事で、速やかに朝のこわばりを含めた症状の改善が見込まれるようです。しかし、夜中に内服する事が困難であるため、次に示す徐放剤の効果が検討されるようになったと考えられます。
●最近では、関節リウマチにおける低用量プレドニゾン時間療法のための最も先進的なアプローチとして、22時に投与するタイミングでプレドニゾンを放出し、さらに2時~3時頃にプレドニゾンを放出するプレドニゾン徐放剤と早朝に即時放出する通常のプレドニゾンを比較した試験(CAPRA試験、Circadian Administration of Prednisone in Rheumatoid Arthritis)が挙げられている(PMID=18207016/20542963)。
→ベースラインから終了時までの朝のこわばりの持続時間の平均相対変化は、即時放出型プレドニゾンよりもプレドニゾン徐放剤の方が有意に高いことが判明した(P=0.045)。→治療群間の絶対差は29.2分(95%CI-2.59~61.9)で、プレドニゾン徐放剤が有利であった(P=0.072)。
●興味深いことに、即時放出型プレドニゾン(朝投与)治療開始から3ヶ月間の重篤な有害事象の発生率は2.4%であったのに対し、12ヶ月間という4倍の期間の夜間プレドニゾン徐放剤投与(4時間延長)を受けた患者ではわずか3.3%であった(PMID=20542963)。
※日本ではステロイドの徐放剤はクローン病で使われるブデソニドしかありません。
関節リウマチにおけるその他の時間療法へのアプローチ
●炎症に関与する様々な細胞(炎症状態の間に正常な概日リズムを失う単球)は特に夜間に活性化されるため、関節リウマチで使用される他の治療法、例えばインドメタシンやアセクロフェナクなどの非ステロイド性抗炎症薬(NSAIDs)は、グルココルチコイド時間療法と同じ概念に従うように合成されてきた(PMID=8977918/22974284/23537465)。
●実際のところ、関節リウマチの免疫/炎症反応に関与する細胞の概日性の活性化は、従来のDMARDsや生物学的DMARDsの優先的なターゲットであり、したがって、抗増殖薬(すなわち、メトトレキサート、レフルノミド、シクロホスファミドなど)の投与は、これらのリズムを考慮しなければならない(図4)。
●この仮説は、関節炎の動物モデルを用いたin vivo調査で検証され、TNF-αの24時間サイクルに関連した最適な投与時間が、最も効率的にメトトレキサートの抗炎症作用と最も効果的なTNF-αの減少をもたらしうることが示された(PMID=19814865)。
●さらに別の臨床研究では、メトトレキサートを就寝時(週に3回、1日1回夕方)に投与する時間療法を行うことで、現在の標準的な投与方法と比較して、関節リウマチの症状がさらに改善されることが確認されている(PMID=21452922)。
●膠原性関節炎(CIA)ラットの血漿IL-6値を調べた最近の研究では、MTXの連日投与を6週間行うことで、IL-6の概日リズム、関節炎スコア、TNF-αおよびCRP値の有意な低下という結果に基づいて、週1回の投与よりも効果的であることが示された(PMID=27900440)。
●興味深いことに、最近の研究では、滑膜線維芽細胞に対するメトトレキサートの新規の概日性の作用が示されており、サーカディアン転写因子であるプロリンと酸性アミノ酸に富む塩基性ロイシンジッパー(PAR bZIP)とサーカディアンクロック遺伝子PERIOD2(PER2)の発現が亢進され、アポトーシスが誘導されることが示されている(PMID=29566767)。したがって、メトトレキサートは、概日環境を調節し、関節リウマチの病態の新たな側面を理解する上で重要であると思われる。
※ステロイドだけでなく、NSAIDsやcsDMARDsも夜間に投与した方が良いのではないかという事が本章では述べられています。ステロイドは不眠を誘発する可能性がある事を考慮すると、NSAIDsなどは眠前に内服しても良いかもしれませんね。今の日本の医療だと、メトトレキサートを週2日以上内服する事は禁忌の扱いですので、少量連日眠前内服などのやり方が流行るか分かりません…
結論
●関節リウマチ患者を特徴づける早朝の関節症状(朝のこわばり)は、免疫/炎症反応の概日性夜間活性化に関連している。免疫細胞の活性化(および関連するサイトカイン合成や他のメディエーターのフレア)の予防/治療は、外因性のグルココルチコイドが夜中に利用できるようになると、より効果的であることが示されている。
●低用量の慢性療法でプレドニゾン徐放剤を投与した関節リウマチ患者で観察された印象的な良好な結果は、NSAIDsやcsDMARDs、bDMARDsなどの他の治療薬にも適用可能であるように思われる。
●関節リウマチの疼痛、こわばり、機能障害は早朝に最大になるため、メトトレキサートの連日夜間投与で得られた良好な結果のように、夜間にグルココルチコイドを投与して夜間の炎症性サイトカインの上昇を防ぐことは、従来のNSAIDsやDMARDsで朝に既に完成してしまった症状を治療するよりも効果的であることが明らかになってきた。
●少なくとも関節リウマチ治療において最良の結果を得るためには、関節リウマチ新薬登録試験実施のためのガイドラインにchronobiology/therapy(時間生物学・時間療法)の概念を早急に導入すべきであると考える。
●恥ずかしながら、『時間生物学・時間療法』という概念を初めて知りました。本文の引用論文を見ると、1990年代からこの概念がずっとあったようですが、なぜあまり注目されていないのか疑問です。
●時間生物学の概念を用いると、夜間の炎症細胞の活性化、そして炎症性サイトカインが上昇するために朝に症状のピークがが来て、『朝のこわばり』が起こるというのは理解しやすいです。
●ただし、注意しなければならないのは、今回の論文の筆者が単一である事です。筆者はイタリアのジェノバ大学の教授で、今までも『時間生物学・時間療法』について何度かReviewなどを書かれていますが、いずれも単一著者です。一般的に複数の著者が入る事で専門家同士の吟味ができるのですが、単一著者である場合は、持論を展開しているだけに過ぎない可能性があります。また、ジェノバ大学自体はイタリアではあまり有名ではない大学のようです。まだ、概念が十分広がっていないだけなのかもしれませんが、概念自体の信憑性に問題がある可能性も残されています。
●本文ではグルココルチコイドの夜間投与が有効であるという研究結果が紹介されていますが、リウマチ膠原病疾患でプレドニゾロン単回投与よりも3分割にする方が効果が出る実感があり、もしかすると、夜間の炎症を抑えるためなのかもしれません。
●プレドニゾン徐放剤が有効であったと紹介されていますが、日本でステロイドの徐放剤というと、クローン病などで使用されるブデソニドぐらいしかないように思います。プレドニゾロンの半減期(27時間)を考えると、単に朝内服から夕食後、眠前内服に変更するだけでも効果が出るかもしれません。症状がいまいち改善しない患者さんで試してみたいな、と思いました。
●グルココルチコイドだけでなく、NSAIDsなども眠前に内服する事が良いかもしれませんね。
●メトトレキサート少量を連日夜内服が効果的、というのは週2日を超えて内服する事を禁忌とする現在の日本では、ややチャレンジングです。
【参考文献】
Maurizio Cutolo, et al. Joint Bone Spine. 2019 May; 86 (3): 327-333. ”Circadian rhythms and rheumatoid arthritis” PMID=30227223





































